
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Будова комплексних сполук
|
|
ВСТУП
Актуальність теми. На сучасному етапі розвитку сільського господарства всі частіше постають проблеми підвищення ефективності його виробництва. Для того щоб забезпечити продуктивність рослинництва та тваринництва раціональною базою кормів, сьогодні приходить на допомогу використання синтетичних препаратів, що є аналогами природних біологічно активних сполук, які виявляють високу біологічну активність щодо сільськогосподарських рослин і тварин.
Також новосинтезовані препарати доповнюють клас сполук, як маркери при дослідженні біологічної активності інших структур. Практичне застосування таких сполук є надзвичайно широким – від харчових добавок до противопухлинних засобів.
Одним із таких препаратів і є спірокарбон, висока біологічна активність якого вже виявлена.
Мета: синтез комплексних сполук спірокарбону та дослідження їх рістрегулюючої активності.
Завдання:
1. Провести аналіз літературних джерел з метою опрацювання методів синтезу гетероциклічних спіросполук та з’ясування особливостей, будови, класифікації комплексних сполук, методик їх синтезу.
2. Здійснити синтез спірокарбону.
3. Синтезувати комплексні сполуки спірокарбону з органічними кислотами.
4. Синтезувати комплексні сполуки спірокарбону з неорганічними солями.
5. Дослідити рістрегулюючу активність синтезованих комплексів.
Об’єкт дослідження: нітрогеновмісні гетероциклічні сполуки. Предмет дослідження: синтез біциклічних біссечовини деканового ряду.
РОЗДІЛ 1
БУДОВА КОМПЛЕКСНИХ СПОЛУК ТА МЕТОДИ СИНТЕЗУ НІТРОГЕНОВМІСНИХ СПІРОСПОЛУК
Будова комплексних сполук
Комплексними (координаційними) сполуками називають такі речовини, у вузлах кристалічної гратки яких містяться складні хімічні частинки, утворені за рахунок координації одним атомом (або кількома атомами) звичайних молекул і йонів, і ці частинки здатні самостійно існувати у розтопленому або розчиненому станах.
Комплексні сполуки утворюють як метали, так і неметали. Комплексна сполука (скорочено — комплекс) складається з центрального атома металу-комплексоутворювача M (тут не вказано його заряд), з яким зв'язані ліганди L (стара назва — аденди). Атом M і ліганди L утворюють внутрішню сферу комплексу (або внутрішню координаційну сферу). Лігандами можуть бути нейтральні молекули (зазвичай основного характеру), негативно заряджені аніони (ацитогрупи). Прості позитивно заряджені катіони в ролі лігандів не виступають. Якщо внутрішня сфера комплексу несе негативний або позитивний заряд, то для компенсації цього заряду необхідні йони, що утворюють зовнішню сферу[1].
Іноді в ролі зовнішньої сфери одного комплексу виступає внутрішня сфера іншого комплексу, наприклад, у сполуках складу: [Co (NH3)5NO2] [Co (NH3)2 (NO2)4] 2 тощо.
Нейтральні молекули, що знаходяться у зовнішній сфері, називають (за винятком молекул води або іншого розчинника) клатратними молекулами, а самі такі сполуки — клатратними сполуками (сполуками — включеннями) [2]. У комплексі ніколу (II) складу NiI2 10A, де A - молекула карбаміду (сечовини) OC(NH2)2, на один атом ніколу припадає десять молекул карбаміду, проте тільки шість з них входять у внутрішню сферу комплексу; чотири інші молекули карбаміду і два йодид-іона утворюють зовнішню сферу. Ці чотиримолекули карбаміду є клатратними молекулами. Склад комплексу в цілому можна представити таким наступним чином: [NiA6] I2 4A.
Ліганд L утворює з металом—комплексоутворювачем M координаційну зв'язок різної хімічної природи (іонна, ковалентні полярні; за походженням —донорно—акцепторні, дативні чи іншої природи). Координаційний зв'язок може бути ординарний, подвійний, потрійний. У комплексних сполуках, містять у внутрішній сфері два атоми металу—комплексоутворювача, можливо в деяких випадках існування і четвертинного зв'язку, наприклад, між двома атомами ренію в комплексі [Re2 Cl8]2- [Cl4ReReCl4]2-.
Координаційне число центрального атома M — це число координаційних зв'язків, що утворюються атомом металу-комплексоутворювача з лігандами. Координаційне число може мати значення 2, 3, 4, 5, 6 і т.д. аж до 12 (наприклад, для деяких сполук рідкоземельних металів). Найбільш часто зустрічаються координаційні числа 2, 4, 6; координаційні числа вище 8 зустрічаються набагато рідше [1].
Число координаційних зв'язків, утворених одним і тим же лігандом з одним атомом металу—комплексоутворювача, називається дентатностю ліганду (стара назва координаційна ємність). Ліганди можуть бути монодентатними і полідентатними (бі-, три-, тетра-, пента-, гексадентатними).
До монодентатних лігандів відносяться F-, Cl-, Br-, I-, H-, CN-, RNH2, NH3, H2O і т.д. Вони утворюють тільки одну координаційний зв'язок (якщо виключити зрозгляду можливість утворення місткових зв'язків між двома атомами металу).
Бідентатні ліганди функціонують, наприклад, в комплексах [CoEn2CO3] — октаедричнї будови і[Pt (C2O4) 2] 2- квадратної конфігурації (En - скорочене позначення молекули етилендіаміну NH2-CH2-CH2-NH2).
До тридентатних лімандів відноситься, триамінопропан NH 2CH2-CH2NH2-CH2NH2.
Полідентатні ліганди не обов'язково повинні реалізувати свою максимальну дентатность [3].
Іноді поняття координаційного числа центрального атома M або дентатності ліганда формально стають невизначеними, наприклад, в дициклопентадіенол феруму Fe(C5H5)3, в дибензенхромі Cr(C6H6)2.
Тут атом металу (феруму або хрому) пов'язаний не з якимось певним донорним атомом, а цілком з усім лігандом — циклопентадіенілом C5H5 (одноразово депротонірованої оcтатком молекули циклопентадієну C5H6) або молекулою бензену. Сполуки подібного типу називають π -комплексами, або ароматичними комплексами металів (якщо ліганд – ароматична сполука). Поняття " π -комплекс" - ширше, ніж поняття " ароматичний комплекс ".Комплексні сполуки можуть бути катіонного типу, аніонного типу та комплексами-неелектролітами.
Внутрішня сфера комплексів катіонного типу несе позитивний заряд, наприклад: [Ag (NH3)2]+, [Cu (NH3)4] 2+, [PtEn2] 2+, [Co(NCS)2En2]+ і т.д.
Внутрішня сфера комплексів аніонного типу несе негативний заряд, наприклад: [Ag(S2O3)2]3-, [Sb(OH)6]-, [Co(NO2)6]3-, [HgI4]2-, [Pt(SCN)4]2-, [PtVF6]- тощо [1].
Внутрішня сфера комплексів—неелектролітів не несе ніякого електричного заряду, наприклад: [Ni(ДМГ)2], де ДМГ - молекула диметилгіоксиму (H3C-C = NOH)2, [Pt(NH3)2Cl4].
Якщо комплекс містить тільки один атом металу- комплексоутворювача, то він називається одноядерним (моноядерних); якщо він містить два або більше атомів, то він називається багатоядерним або поліядерним (біядерним, тріядерним і т.д.). Так, наприклад, комплекс паладію(II) [PdCl4]2-, що має тільки одинцентральний атом — атом паладію(II), є одноядерним, а комплекс платини (II) [Pt2(NH3)2Cl2], що містить два атоми платини (II), - біядерним.
Якщо поліядерні комплекси містять атоми металу однакової хімічної природи, то вони називаються гомометалічними; якщо у поліядерному комплексі є атоми металу—комплексоутворювача різної хімічної природи, то такі комплекси називаються гетерометалічними.
У багатоядерних комплексах можуть здійснюватися також зв'язки метал-метал. Якщо зв’язків метал—метал досить багато (зазвичай - більше трьох), то такі комплекси називають " кластерними сполуками" або просто " кластерами" (слово " кластер" означає " рій", " скупчення")[2]. Координаційний зв'язок метал-ліганд, як уже зазначалося, може бути одинарним, подвійним, потрійним (і навіть четвернним зв'язком метал-метал в деяких комплексах). Так, у тетраамонійному комплексі купрум(II) [Cu(NH3)4]2+ є чотири полярні ковалентні ординарні координаційні зв'язки, донорно- акцепторні за походженням.
Кожний такий координаційний зв'язок купрум(II)-амоніак утворюється за рахунок відтягування " вільної" електронної пари від атома нітрогену молекули амоніаку на порожню атомну орбіталь купрум(II), що в записі хімічної формули позначається стрілкою, спрямованої від донора до акцептора. Донором електронної пари, таким чином, є молекула амоніаку, акцептором електронної пари — купрум(II). У результаті усуспільнення електронних пар і утворюються чотири координаційні зв'язки купрум(II)-амоніак.
У комплексному ферроціанід-іоні [Fe(CN)6]3- є шість координаційних зв'язків ферум(II) —нітрильна група, які умовно можна позначити таким чином: Fe(II)CN- .
Ці координаційні зв'язки - подвійні ковалентні (полярні), що складаються з одного донорно-акцепторного s-компонента і одного дативного p-компонента. Механізм утворення таких зв'язків в якісній формі можна представити таким чином. Ціанід-іон CN- має " вільну" електронну пару, яка відтягується при комплексоутворенні до атома феруму(II), в результаті чого виникає s-донорно-акцепторна (від ліганда до метала) складова координаційного зв'язку. З іншого боку, атом феруму(II) з d-електронною конфігурацією 3d6 може переміщати свої d-електрони на порожню розпушуючу молекулярну p-орбіталь вітрильної групи, в результаті чого виникає p-дативна (від металу до ліганда) складова координаційного зв'язку [1].
Таким чином усуспільнення електронів як лімандів так і металів-комплексоутворювачів виникає подвійний ковалентно-полярний координаційний зв'язок ферум(II)-нітрильна група. Внаслідок всіх цих перерозподілів електронної густини в шести координаційних зв'язках ферум(II)-нітрильна група позитивний заряд на атомі феруму(II) вже не дорівнює двом, а негативний заряд на вітрильній групі також вже не дорівнює мінус одиниці.
Аналогічна картина характерна і для більшості інших комплексів металів, в яких багатозарядні катіони металів в дійсності не існують, оскільки комплекс складається не з " чистих" іонів, а з центрального атома металу і лігандів, усуспільнили свої електрони. Це стосується частинок внутрішньої координаційної сфери.
У зовнішній же сфері присутні катіони і аніони з зарядами, відповідними їх йонну стану. Наприклад, у комплексі K4[Fe(CN)6] у зовнішній сфері є чотири катіона калію K+; у зовнішній сфері комплексу [Ag(NH3)2] Cl знаходиться хлорид-аніон Cl- і т.д.
Вище наведений короткий розгляд природи координаційних зв'язків у рамках методу валентних зв'язків є спрощеним і лише в якісній формі відображає реальну картину. В даний час найбільш поширеними є три підходи дорозуміння природи хімічного зв'язку в координаційних сполуках металів: теорія кристалічного поля, метод валентних зв'язків та теорія (метод) молекулярних орбіталей. Найбільш точну картину можна отримати за допомогою методу молекулярних орбіталей [3].
Структура комплексів експериментально встановлюється рентгеноструктурним та спектральними методами [2].
Комплексні сполуки класифікують також за природою центрального атома та характером його зв’язку з лігандами. За цим принципом комплекси поділяють на такі основні групи:
1. Моноядерні сполуки з позитивним ступеня окиснення центрального атома. До них відносять акво-, аміно-, ацидокомплекси.
2. Поліядерні сполуки, які містять два або кілька центральних атомів того самого або різних елементів з позитивним ступенем окиснення. Для них характерним є утворення місткових зв’язків через один, два або три ліганди. Тому комплекси можуть з’єднуваться між собою вершинами, ребрами або гранями. Зв’язувальними містками можуть бути атоми чи групи –Cl, -O-, -O-O-, -OH, -NH2, -SO4.
3. Сполуки з негативним ступенем окиснення центрального атома. Це – полігалогеніди (Na[I(I2)4]), політіосульфіди (Na2[S3]), сполуки на основі полікарбонілометалів (Na[Co(CO)4]).
4. Сполуки з нульовим ступенем окиснення центральних атомів. До цієї групи відносять полікарбонілометали, наприклад, [Fе(СО)5], деякі ціаніди, амінокомплекси тощо.
5. π -Комплекси містять ліганди з π -зв’язками (органічні ненасичені молекули), які координуються центральним атомом через систему π -зв’язків. Наприклад, сіль Цейзе - К[РtС13(С2Н4)].
6. Сандвічеві сполуки, будова яких нагадує сандвіч (бутерброд), оскільки їхні центральні атоми розташовані між площинами двох лігандів. Прикладом є дибензолохром Cr(C6H6)2.
7. Клатрати, або сполуки включення, утворені заглибленням молекул або атомів однієї речовини у вільні порожнини кристала або у порожнину великої молекули іншої речовини. Матрицями для утворення клатратів можуть бути лід, фенол, гідрохінон тощо. Прикладом клатратів є гідрат ксенону, граничний склад якого 4Хе . 23Н20. Клатрати мають змінний склад, оскільки він визначається ступенем заповнення порожнин у структурі основної речовини.
8. Адукти – комплексні сполуки, що утворилися в результаті реакції приєднання двох нейтральних молекул, одна з яких є донором, а друга акцептором електронів.
9. Внутрішньокомплексні сполуки (ВКС) – координаційні сполуки металів з однаковими або різними бідентатними (зазвичай - органічними) ацито-лігандами, пов’язаними з одним і тим же атомом металу-комплексоутворювача через одну негативно заряджену і одну нейтральну донорні групи з утворенням однакових або різних внутрішніх металоциклів (хелатних циклів), що не містять зовнішньосферні йонів і які є комплексами-неелектролітами. Прикладом ВКС може служити купрум(ІІ)гліцинат: [Cu(NH2CH2COO)] [].
ВКС окремим випадком хелатних комплексних сполук (хелатів) металів (ХКС), тобто координаційних сполук металів з однаковими або різними негативно зарядженими або нейтральними полідентатними ліганди, органічними або неорганічними, мають один або кілька однакових або різних хелатних циклів (термін " хелат" - chelate - означає " клешнеподібне"). Хелати, на відміну від ВКС, можуть бути комплексами катіонного, аніонного типу або комплексами-неелектролітами, містити у внутрішній координаційній сфері одночасно один або тільки полідентатних, монодентатних лімандів і мати (або не мати) зовнішньосферних йонів.
Поняття ВКС і ХКС іноді тотожні: будь-які ХКС, що містять принаймні один хелатний цикл, нерідко називають ВКС. У ХКС один і той же полідентатних ліганди утворює один або кілька хелатних циклів, причому цей ліганди може бути бі-, три-, тетра-, пента- або гексадентатним. Так, в комплексах металів з діметілгліоксімом реалізуються хелатні металоцикли.
Велику групу хелатних комплексів утворюють етилендіамін H2N-CH2-CH2-NH2 (часто для стислості позначається En або en), що утворює п’ятичленні металоцикли, наприклад, в комплексі платини (II) [Pt(en)2]CI2.
Полідентатних (циклоутворючі) ліганди утворюють в ВКС і ХКС зазвичай чотирьох-, п'яти-, шести-, семічленні металоцикли. Значно рідше здійснюються тричленні металоцикли або хелатні цикли з числом членів більше семи. ВКС і ХКС найчастіше утворюються внаслідок реакціях солей металів з відповідними нейтральними вихідними ліманди або їх солями в розчинах в відповідних умовах, та при реакціях внутрішньосферного заміщення і внутрішньосферного перетворення лігандів.
ВКС - зазвичай малорозчинні у воді, часто - забарвлені речовини, можуть екстрагуватися органічними розчинниками, не змішуються з водою. ХКС володіють різною розчинністю і забарвленням, залежать від природи металу-комплексоутворювача, та лігандів зовнішньої сфери. ВКС і ХКС більш стійкі термічно та до дисоціації у розчинах, ніж комплекси тих же металів з монодентатними ліганди, що утворюють аналогічні координаційні зв'язки. Підвищена стійкість п'ятичленних металоциклів, меншою мірою - шестичленних металоциклів відома як правило циклів Чугаєва: найбільш стійкі комплекси з п'ятичленними хелатними циклами, менш стійкі - сполуки з шестичленними хелатними циклами. Сполуки з трьох-, чьотирьохчленними металоциклами та циклами, що мають більше шести членів, зазвичай набагато менше стійкі. Стійкість ВКС і ХКС росте із збільшенням числа металоциклів в комплексі.
ВКС і ХКС широко застосовуються в аналітичній хімії для визначення металів, при їх осадженні і розподілі, а також в якості каталізаторів, барвників і пігментів, фармакологічно активних компонентів лікарських препаратів, стабілізаторів вин тощо.
Багато комплексних сполук є каталізаторами різних процесів гомогенного та гетерогенного каталізу. Часто при отриманні лікарських препаратів на основі фармакологічно активних комплексних сполук вдається знизити токсичність як металу, так і лігандів, зв’язаних в комплексі, і модифікувати в бажаному напрямку їх біологічну активність [2].
1.2. Способи одержання нітрогеновмісних гетероциклічних спіросполук
Спіросполуки представляють собою особливу групу органічних сполук, що містять так званий спіроатом, найчастіше спіроатом Карбону. Ці сполуки представляють собою конденсовані системи мінімум з двома циклами, сполученими спільним атомом Карбону, що перебуває в стані sp3 -гібридизації. Причому список спіросполук значно розширюється, за умови одержання гетеро циклів.
Розробка методик синтезу спіросполук – досить кропітка робота і на сьогодні більшість відомих спіросполук одержана випадково використовуючи ті чи інші відомі механізми реакцій, але з “некласичними” для цих синтезів сполуками.
Одержання сполук типу спiробі(гексагідрогенпiримiдинів)
а) Конденсація ацетону з сечовиною за схемою [6, 8]:

1.1
в) Конденсація диненасичених (1.2) кетонів з сечовинами за схемою [6, 7]:

1.2 1.3
Синтез похідних піримідину реакцією циклоконденсації з С-Н-кис-лотами та іншими сполуками
Альдегіди займають особливе положення серед С-Н–кислотних сполук, вони здатні реагувати не тільки як нуклеофільні, а і в деяких випадках як карбонільні компоненти в цих циклоконденсаціях [4, 5].

Нижче наведено ряд відносної активності аліфатичних С-Н–кислотних сполук в реакціях цикло-2-уреідоалкілювання [6].
1.4
В реакціях з сечовиною або сполуками, що містять NН-групи, у м'яких умовах, тобто в слабо кислому середовищі, аліфатичні та ароматичні альдегіди звичайно ведуть себе як карбонільні компоненти і дають лінійні продукти конденсації, подібні за структурою до продуктів конденсації сечовин з формальдегідом. В більш кислому середовищі і при підвищеній температурі відбувається α -уреідоалкілювання С-Н–кислотною групою альдегіду. В присутності кислот в результаті конденсації сечовини, тіосечовини, гуанідину, їх моно- або симетрично заміщених похідних з альдегідами, які мають хоча б один атом гідрогену в α -положенні до карбонільної групи, утворюються 4-гідроксигексагідрогенпіримідинони (1.5) [ 4, 5, 6, 7].
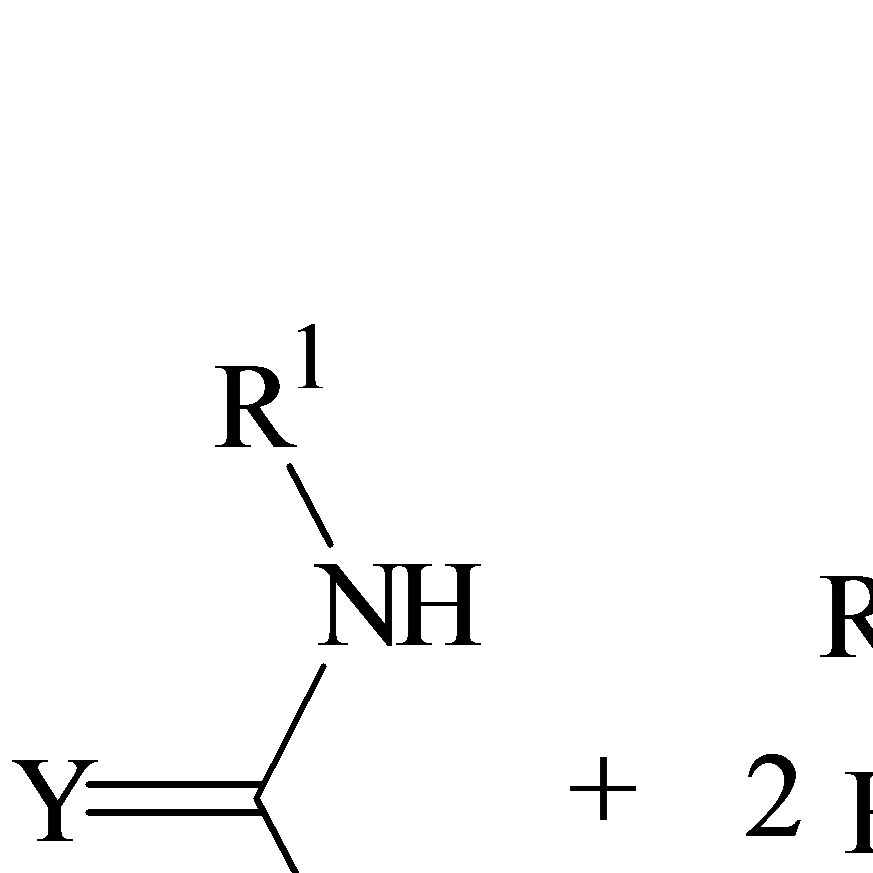
1.5 1.6
4-алкоксигексагідрогенпіримідинони (1.6) утворюються, якщо ця конденсація проводиться в спиртах [4, 5, 6, 7]. Ці циклоконденсації можуть використовуватися при реакціях сечовин та тіосечовин з двома різними альдегідами за умови, що хоча б один із них має С-Н–кислотний характер. Так, наприклад, циклоконденсація одного моля сечовини з одним молем формальдегіду і одним молем ізомасляного альдегіду в присутності кислоти призводить до утворення 5, 5-диметил-4-гідроксигексагідрогенпіримідин-2-она (1.7).

1.7
1, 2, 3, 6-тетрагідрогенпіримідин-2-они (1.8). 4-гідрокси(алкокси)-гексагідрогенпіримідин-2-они (1.6) можуть бути перетворені в 1, 2, 3, 6-тетрагідрогенпіримідинони (1.8) в у присутності кислоти видаленням води або спирту.

1.6 1.8
У багатьох випадках 1, 2, 3, 6-тетрагідрогенпіримідинони (1.8) можуть бути отримані з хорошим виходом реакцією сечовин з α, β -ненасиченими альдегідами або α, β -ненасиченими кетонам шляхом вінілуреідоалкілірован-ня [7, 8, 9, 10, 11].
Кетони з лабільними атомами гідрогену в α -положенні до карбонільної групи можуть як С-Н–кислотні альдегіди одночасно реагувати як карбонільні сполуки і як нуклеофільний реагент з сечовиною, утворюючи моно-, ди- та поліциклічні гетероцикли відповідно принципу α -уреідоалкілування. Так як більшість кетонів мають більше одного лабільного атому гідрогену, то це затрудняє можливість передбачити які положення в кетоні будуть підлягати α -уреідоалкілуванню [10, 12].
Сучасні досліди показують, що конденсація сечовини чи тіосечовини з діалкілкетонами дає гетероцикли типу (1.9, 1.10) [7, 8, 13, 14, 15, 16]:
1.9 1.10
Гетероцикли типу (1.10) можуть бути одержані з великим виходом реакцією сечовини чи тіосечовини з α, β -ненасиченими кетонами відповідно до принципу вінілуреідоалкілування [ 15, 16, 17].
Циклоконденсація вінілуреідоалкілування
Вінілалкіліруючи агенти отримані приєднанням NH або NH2 групи сечовини, тіосечовини, гуанідіна або сульфаміда до карбонільної групи α, β -ненасичених альдегідов або кетонів [ 6, 7, 8, 21, 22].
Обробка β, γ -ненасичених N-(1-гідроксиалкіл)-сечовин (1.11) кислотним каталізатором приводе до утворення уреідоалкілкарбоновим іонам (1.12), які мезомерно стабілізовані. Ці іони можуть реагувати з другою NH або NH2 групою сечовини, тіосечовини, гуанідіна або сульфаміда циклізуючись з утворенням тетрогідрогенпіримідина (1.9) і подібних продуктів.
Подібно реакціям α, β -ненасичених альдегідов з сечовиною, реакції з ди-α, β -ненасиченими кетонами і відповідними сечовинами або тіосечовинами у кислому середовищі приводе до утворення гексагідрогенпіримідин-2-она-(4-спіро-4)- гексагідрогенпіримідин-2-она [ 6, 7, 8, 21].
Синтез аналогів спірокарбону зі сполук типу гексагідрогенпіримідин-2-она.
У попередньому пункті ми розглядали одержання похідних піримідіну, а саме сполук типу 4, 6, 6-триметил-1, 2, 3, 6-тетрагідрогенпіримідин-2-они, які є проміжною стадією в синтезі аналогів спірокарбону.
В присутності лугу 4, 6, 6-триметил-1, 2, 3, 6-тетрагідрогенпіримідин-2-они (1.8) конденсуються з бензальдегідом, утворюючи 6, 6-диметил-4-стирил-1, 2, 3, 6-тетрагідрогенпіримідин-2-они ((1.13) R1=R2=Н) [ 23 ]:
Сечовина приєднується до сполуки (1.13) у кислому середовищі утворюючи 6, 6-диметил-2-оксогексагідрогенпіримідин-(4-спіро-4)-6-фенілгексагідрогенпіримідин-2-он (1.14) [23, 28, 26]:

1.13 1.14
4-метил-тетрагідрогенпіримідин-2-они (1.9) можуть кондесуватися з ацетоном у присутності кислоти, утворюючи 4-ізобутиліден-тетрагідрогенпіримідин-2-они (1.15), які в реакції з сечовиною, утворюють тетрагідрогенпіримідин-2-они-(4-спиро-4) тетрагідрогенпіримідин-2-они (1.17). Додавання сечовини до (1.9) приводе до утворення 4-метил-уреідогексагідрогенпіримідин-2-они (1.16), який також утворює (1.17) у кислому середовищі з ацетоном [16].
Аналіз літературних джерел показав, що карбонільним сполукам властиві різноманітні реакції конденсації, що є цінними у відношенні використання їх для розробки синтезів препаратів – аналогів спірокарбону які володіють біологічною активністю. Розглянуто загальні методи синтезу сполук типу спiробі(гексагідрогенпiримiдинів), а також синтез сполук типу гексагідропіримідин-2-она, які використовують для подальшого синтезу аналогів спірокарбону.
РОЗДІЛ 2
ОДЕРЖАННЯ СПІРОКАРБОНУ ТА ЙОГО КОМПЛЕКСНИХ СПОЛУК
2.1. Синтез спірокарбону та його комплексних сполук
Спірокарбон (2.1) являє собою спіросполуку, що складається з двох гетероциклів кожен з яких містить два атоми нітрогену та чотири атоми карбону, один з яких є спiльним. Кожне кільце містить карбонільну групу. Цикли перебувають в трансконфiгурацiї відносно спільного атома карбону у зв’язку з стеричними перешкодами та взаємним відштовхуванням неподiльних пар електронів атомів нітрогену при спільному атомі карбону[24]:

2.1
Синтез спірокарбону був здійснений двома шляхами. Кожен з них ґрунтувався на взаємодії сечовини з кетонами або їх похідними у присутності сильної кислоти [ 22, 23].
В основі метода А лежить взаємодія сечовини з ацетоном у спiввiдношеннi 2: 3 в присутності концентрованої сульфатної кислоти:

2.2
В результаті реакції одержується сульфатнокисла сіль спірокарбону (2.2).
З цієї солі нейтралізацією концентрованим розчином лугу із подальшою перекристалізацією з води був отриманий спірокарбон.

2.2 2.1
Чистий продукт представляє собою безбарвні голчасті кристали малорозчинні у воді. Вихід продукту за методом А складає 79%.
Механізм реакції конденсації сечовини з ацетоном полягає в тому, що спочатку відбувається протонiзацiя молекули ацетону з утворенням карбкатiону. Далi відбувається атака карбокатiону атомом нітрогену молекули сечовини, що має неподілену електронну пару. Утворені промiжнi частинки конденсуються мiж собою та ще з однією молекулою ацетону за участю концентрованої сульфатної кислоти з утворенням молекули сульфатнокислого продукту:

Cпірокарбон можна одержати й методом Б. Метод ґрунтується на взаємодії сечовини з фороном у присутності концентрованої сульфатної кислоти:

2.3 2.2
Вихід спірокарбону за методом Б – 84%.
Дослідивши отримані дані встановили, що метод А є менш рентабельним, оскільки вихід продукту при одержанні форону є не таким високим (31 %), i якщо підрахувати вихід продукту при одержанні спiрокарбону з форону, враховуючи вихід самого форону то загальний вихід бажаного продукту складе менше 79%. Тобто найбільш раціонально синтезувати спiрокарбон безпосередньо з ацетону та сечовини. Але цей метод можна використовувати для одержання аналогів спірокарбону [20, 21, 27 ].
ПМР-спектр: 1, 18д (12Н, СН3); 1, 83 – 1, 94к (4Н, СН2); 6, 43д (4Н, NH).
 Рис. 1.1 ПМР- спектр спірокарбону
Рис. 1.1 ПМР- спектр спірокарбону
Синтез комплексних сполук спірокарбону
Взаємодією спірокарбону з бурштиновою кислотою, саліциловою або бензойною кислотою при кип’ятінні у спирті були одержані їх комплексні сполуки (2.4, 2.5, 2.6).
2.4
2.5
2.6
За результатами елементного аналізу та ЯМР-спектроскопії комплекс бурштиновою кислотою (2.4) має склад 1спірокарбон·1бурштинова кислота.
ПМР-спектр: 1, 21с (12Н, СН3); 1, 81-1, 92с (4Н, СН2); 4, 2т (4Н, СН2СООН); 6, 21 с (4H, NH).  Рис. 1.2 ПМР-спекрт сполуки спірокарбону з бурштиновою кислотою
Рис. 1.2 ПМР-спекрт сполуки спірокарбону з бурштиновою кислотою
Одержані сполуки представляють собою тугоплавкі кристалічні речовини, добре розчинні у воді (таблиця 2.1)
Таблиця 2.1
Вихід комплексних сполук спірокарбону та їх фізичні константи
| Сполука | Комплекс із бурштиновою кислотою | Комплекс із саліциловою кислотою | Комплекс із бензойною кислотою |
| Зовнішній вигляд | Білі кристали | Білі кристали | Білі кристали |
| Брутто формула | С14N4O6H26 | C18N4O5H26 | C17N4O4H26 |
| Молярна маса г/моль | |||
| Температура плавлення, º С | |||
| Вихід, % | 78, 6 | 68, 2 |
Комплекси спірокарбону з кислотами були одержані взаємодією реагентів, при нагріванні в полярному органічному розчиннику. При використанні неполярного розчинника вихід продукту зменшується.
Було здійснено ряд синтезів спірокарбону з неорганічними солями в полярному розчиннику. Одержано такі комплекси:
1) Комплекс Cпірокарбон*СаCl2:

2) Комплекс Cпірокарбон*MgSO4:
3) Комплекс Спірокарбон*MnSO4:
4) Комплекс Спіокарбон*CuSO4:
5) Комплекс Спірокарбон*BaCl2:
6) Комплекс Спірокарбон*K2SO4:
7) Комплекс Спірокарбон* MgCl2:

Комплекси утворюються за рахунок неподiленої електронної пари атома Нiтрогену в циклi молекули спiрокарбону та вiльної орбiталi атома металу, що входить до складу солi.
Одержанi сполуки представляють собою безбарвнi тугоплавкі кристалічнi речовини, практично всі добре розчиннi у воді. При згоряннi на електроплитцi, комплексні сполуки залишають золу вiдповiдної солi металу.
|
|