
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторна робота № 6
|
|
Тема. Властивості карбонових кислот
Мета: набути навиків проведення хімічних реакцій з карбоновими кислотами практично здійснити реакції солеутворення карбонових кислот.
Прилади та реактиви: розчин оцтової кислоти (СН3СООН), олеїнова кислота (С17Н33СООН) розчини солей: купрум сульфату(СuSO4 ), натрій карбонату (Na2CO 3 ), магній (порошок Mg), розчин лугу (NaOH), бромна вода (Br2), купрум(ІІ) оксид (CuO), метилоранж, штатів з пробірками, тримачі.
Карбоновими кислотами називаються органічні речовини, молекули яких містять одну або кілька карбоксильних груп сполучених з вуглеводневим радикалом.
Залежно від природи радикала, сполученого з гідроксильною групою, карбонові кислоти поділяють на насичені й ненасичені. Якщо в молекулі міститься одна карбоксильна група, то кислота називається одноосновною, дві — двохосновною і т. д.
Загальна формулі одноосновних карбонових кислот:
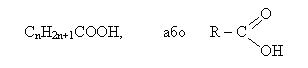
R- радикал або атом водню (у мурашиній кислоті).
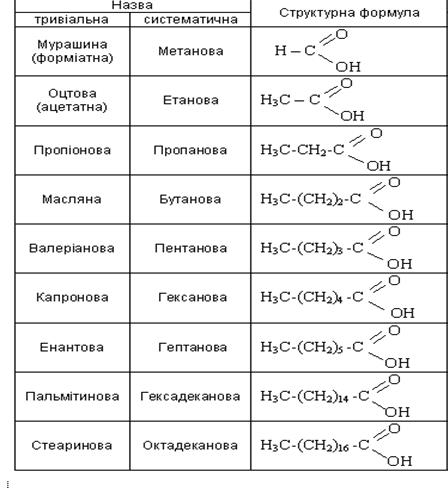
Для найпоширенізпих карбонових кислот часто використовуються такі історичні назви, як мурашина, масляна, валеріанова тощо. Ці назви пов'язані переважно з тими джерелами, з яких була виділена та чи інша кислота: мурашина — з мурашок, оцтова — з оцту, масляна — з масла. За систематичною номенклатурою назву кислот утворюють із назв відповідних насичених вуглеводнів, додаючи до них закінчення -ова і слово кислота.
Температури кипіння наведених кислот монотонно підвищуються. Кислоти мають вищі температури кипіння, ніж спирти з такою самою кількістю вуглецевих атомів у молекулі, що зумовлено асоціацієвз молекул кислот за рахунок водневого зв'язку. Міцність водневого зв'язку в кислотах приблизно вдвічі вища, ніж у спиртів- Щоб пояснити це, розглянемо розподіл електронної густини в молекулі кислоти.

У карбонільній групі, як нам відомо, зв'язок полярний: електронна густина від атома вуглецю зміщена до атома кисню, тому на карбонільному вуглеці з'являється частковий позитивний заряд. Намагаючись компенсувати свій заряд, атом вуглецю відтягує до. себе неподілену пару електронів атома кисню гідроксильної групи. У свою чергу атом кисню відтягує електронну густину зв'язку внаслідок чого атом водню стає рухливим і легше відщеплюється у вигляді протона.
Саме більша полярність зв'язку О—Н в карбоксилі, ніж у спиртів, зумовлює міцніші міжмолекулярні водневі зв'язки, утворені за рахунок карбонільного кисню однієї молекули і водню карбоксилу іншої молекули кислоти. Рідкі кислоти, складаються із спарених молекул - димерів:
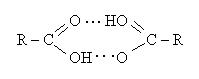
Завдяки тому, що кислоти легко утворюють два водневі зв'язки, димери їх міцні, а температури кипіння вищі, ніж у спиртів. Таким чином, водневий зв'язок у кислотах зумовлює їх відносно високі температури кипіння і розчинність у воді. Як і у спиртів, розчинність кислот знижується із збільшенням їхньої молекулярної маси, тобто із збільшенням в їхніх молекулах вуглеводневого радикала.
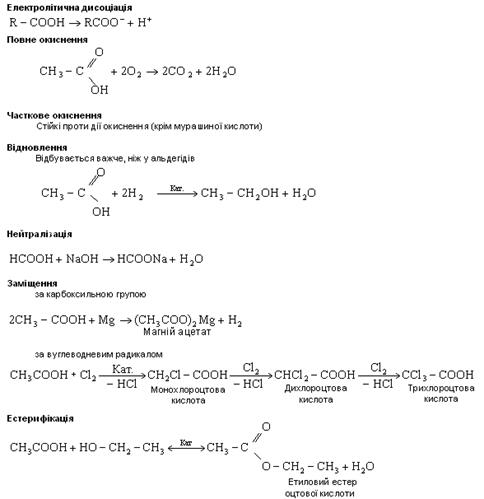
Хімічні властивості карбонових кислот зумовлені передусім наявністю в їхніх молекулах гідроксильної групи. На відміну від спиртів розчинні у воді кислоти мають характерний кислий смак, забарвлюють лакмус у червоний колір, проводять електричний струм.
Проте порівняно з мінеральними кислотами, такими, як НСl, Н2SO4 та іншими, органічні кислоти набагато слабкіші, але сильніші від вугільної кислоти. Усі карбонові кислоти — слабкі електроліти (НСООН — середньої сили). Із збільшенням вуглеводневого радикала сила кислот знижується. Введення галогену до вуглеводневого радикала збільшує силу карбонових кислот.
Карбонові кислоти вступають у реакції, властиві мінеральним кислотам. Вони взаємодіють з активними металами, основними оксидами, основами, солями вугільної кислоти.
Карбоновим кислотам властиві реакції, які не зустрічалися в неорганічній хімії. Так, вони реагують із спиртами за наявності сильних кислот, утворюючи естери. Якщо до оцтової кислоти додати етиловий спирт і трохи сірчаної кислоти, то при нагріванні з'являється приємний ефірний запах оцтово-етилового естеру. У цій реакції бере участь ОН-група карбоксилу:
Хід роботи
Дослід 1.Дисоціація карбонових кислот
В пробірку налийте 1 мл розчину оцтової кислоти та додайте 1-2 краплі метилоранжу. Як змінилося забарвлення? Запишіть спостереження, рівняння реакції та висновки.
Дослід 2. Pеакції солеутворення
2.1. Взаємодія карбонових кислот з гідроксидами металів.
В пробірку з досл. 1 доливайте розчину натрій гідроксиду до зміни забарвлення. Запишіть рівняння відповідної реакції, спостереження та висновки.
2.2 Взаємодія карбонових кислот з активними металами.
В пробірку налийте 1-1, 5мл оцтової кислоти, додайте невелику кількість порошку магнію. Запишіть спостереження, рівняння реакції та висновки.
2.3. Взаємодія карбонових, кислот з основними оксидами
До Імл оцтової кислоти додайте 1г купрум (П) оксиду. Обережно нагрійте. Виникнення синього забарвлення розчину свідчить про присутність гідратованих йонів міді. Запишіть відповідне рівняння реакції, спостереження та висновки.
2.4. Взаємодія карбонових кислот з солями
До 1-1, 5мл оцтової кислоти долийте розчину натрій карбонату. Запишіть спостереження, рівняння відповідної реакції та висновки.
Дослід 3. Вивчення властивостей ненасичених карбонових кислот.
В пробірку налийте 1 мл олеїнової кислоти та долийте 1 мл бромної води. Енергійно збовтайте. Як змінилося забарвлення? Запишіть спостереження, рівняння реакції та висновки.
Контрольні запитання.
- Що таке карбонові кислоти? Як вони класифікуються?
- Як утворюються назви карбонових кислот за номенклатурою ЮПАК та раціональною?
- Які хімічні властивості карбонових кислот ви знаєте?
- Які специфічні властивості мають: а) мурашина кислота, б) стеаринова кислота, в) олеїнова кислота?
- Як залежить розчинність карбонових кислот від молекулярної маси та кількості карбоксильних груп?
- Як виявити карбонову кислоту серед інших органічних речовин?
- Виконати перетворення: етан→ етилен → етанол→ → етаналь→ етилацетат
|
|