
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Квантовые числа электронов
|
|
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси.
Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, c одинаковыми n и l - подур
Магнитное квантовое число (m) характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0. Это означает, что для каждой формы орбитали существует (2l + 1) энергетически равноценных ориентации в пространстве.
Для s- орбитали (l = 0) такое положение одно и соответствует m = 0. Сфера не может иметь разные ориентации в пространстве.
Для p- орбитали (l = 1) - три равноценные ориентации в пространстве (2l + 1 = 3): m = -1, 0, +1.
Для d- орбитали (l = 2) - пять равноценных ориентаций в пространстве (2l + 1 = 5): m = -2, -1, 0, +1, +2.
Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие
9. Многоэлектронные атомы. Принципы и правила их заполнения. Электронные формулы атомов. Связь строения атомов с положением в периодической системе.
10. Периодический закон. Периодическая система химических элементов. Периодичность изменения радиусов, энергии ионизации, энергии сродства к электрону. Электроотрицгельность.
Периодический закон в формулировке Д.И. Менделеева:
| Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. |
На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов.
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром.
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек.
Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома или иона.
Энергия ионизации I выражается в кДж∙ моль–1 или эВ∙ атом–1. Значение I в электронвольтах численно равно потенциалу ионизации, выраженному в вольтах, поскольку E = e-·I.
Э+ – e– = Э+, Δ H = I1 – первый потенциал ионизации; Э – e– = Э2+, Δ H = I2 – второй потенциал ионизации и т.д. I1 < I2 < I3 < I4...
Энергия ионизации определяет характер и прочность химической связи и восстановительные свойства элементов.
Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов (рис. 2.4).
I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду I1 резко понижается – он минимален у щелочных металлов.
энергия сродства к электрону – энергия, выделяющаяся при присоединении электрона к нейтральному атому. Чем больше электронное сродство, тем более сильным окислителем является данный элемент.
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ, величина, характеризующая способность атома к поляризации ковалентных связей. Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.

ряд электроотрицательностей
Элементы, стоящие левее, будут оттягивать общие электроны от элементов стоящих правее.
II. Химическая связь и ее основные характеристики. Типы химической связи. Ковалентная связь и механизмы ее образования. Полярная связь. Дипольный момент и полярность молекул. Механизмы образования ковалентной связи, а- и л- связи. Кратность связи.
Химической связью называют взаимодействие, удерживающее атомы в молекулах и обуславливающее стабильность молекул в определенных условиях.
Основные характеристики химической связи:
Энергия связи (ЕСВ) – минимальная энергия, необходимая для разрушения связи.
Измеряется в электронвольтах (эВ) для одной связи или в кДж/моль для одного моля связей. Энергия связи является характеристикой прочности связи – чем выше энергия связи, тем прочнее связь.
Длина связи (LСВ) – расстояние между ядрами связанных атомов. Измеряется в нанометрах (нм) или в ангстремах (А). Чем короче связь, тем она, как правило, прочнее.
Таблица.Типы химической связи и их основные отличительные признаки.
| Химическая связь | Связываемые атомы | Характер элементов | Процесс в электронной оболочке | Образующиеся частицы | Кристаллическая решетка | Характер вещества | Примеры |
| Ионная | Атом металла и атом неметалла | Электроположительный и электро отрицательный | Переход валентных электронов | Положительные и отрицательные ионы | Ионная | Солеобразный | NaCl CaO NaOH |
| Ковалентная | Атомы неметаллов (реже-атомы металлов) | Электроотрицательный реже электроположительный | Образование общих электронных пар, заполнение молекулярных орбиталей | Молекулы | Молекулярная | Летучий или нелетучий | Br2 CO2 C6H6 |
| --------- | Атомная | Алмазоподоб ный | Алмаз Si SiC | ||||
| Металличес кая | Атомы металлов | Электроположительный | Отдача валентных электронов | Положительные ионы и электронный газ | Металлическая | Металлическая | Металлы и сплавы |
КОВАЛЕНТНАЯ СВЯЗЬ.
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
| Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др. |
| Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2. Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером. |
σ - связь значительно прочнее π -связи, причём π -связь может быть только с σ -связью, За счёт этой связи образуются двойные и тройные кратные связи.
Полярные ковалентные связи образуются между атомами с разной электроотрицательностью.
12. Свойства ковалентной связи. Валентные возможности атомов. Гибридизация атомных орбиталей (основные типы гибридизации с примерами). Геометрия молекул.
Свойства ковалентной связи
Характерные свойства ковалентной связи – направленность, насыщаемость, полярность, поляризуемость – определяют химические и физические свойства органических соединений.
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяют реакционную способность молекул по отношению к полярным реагентам.
Валентные возможности атомов определяются не только числом неспаренных электронов, но и числом неподеленных электронных пар, способных переходить на свободные ор-битали атомов другого элемента. Поскольку валентные возможности атомов ограничены, важнейшим свойством ковалентной связи является насыщаемость химических сил сродства. За счет донорно-акцепторного механизма увеличиваются валентные возможности атомов. В соединениях NH3 и BF3 азот и бор трехвалентны, в соединении H3NBF3 азот и бор четырехвалентны. Таким образом, валентность атомов зависит не только от количества неспаренных электронов, но и от наличия вакантных орбиталей и неподеленных электронных пар. Из общего количества электронных пар в образовании связи обычно участвует не больше одной.
В таблице ниже представлена краткая характеристика всех типов гибридизации с участием s -, p - и d -орбиталей
| Коорд. число | Тип гибридизации | Пространственная конфигурация молекулы, центральный атом которой подвергается гибридизации | Расположение атомов в молекуле | Примеры соединений |
| sp | Линейная | 
| BeCl2, CO2, HCN | |
| pd | Линейная | ↑ | ||
| sd | Угловая | 
| ||
| sp 2 | Тригональная | 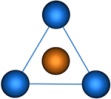
| BF3, BCl3, NO3-, HgI3-, CdCl3- | |
| sd 2, p 2 d | Тригональная | ↑ | ||
| spd | Неправильный треугольник | |||
| sp 3 | Тетраэдрическая | 
| CH4, CCl4, XeO4, HgI4-, BF4- | |
| pd 2 | Тетраэдрическая | ↑ | ||
| p 3 d, pd 3 | Неправильный тетраэдр | |||
| sp 2 d | Тетрагональная | 
| [PdCl4]2-, [Pt(NH3)4]2+ | |
| p 2 d 2 | Тетрагональная | ↑ | ||
| p 2 d 3 | Пентагональная | 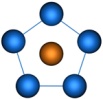
| ||
sp 3 d 
| Пирамидальная | 
| Sb(C6HC5)5 | |
| sp 2 d 2, sd 4, pd 4, p 3 d 2 | Пирамидальная | ↑ | ||
sp 3 d 
| Тригонально-бипирамидальная | 
| PF5, PCl5, SbCl5 | |
| spd 3 | Тригонально-бипирамидальная | ↑ | ||
| sp 3 d 2 | Октаэдрическая | 
| SF6, PF6-, SiF62- | |
sp 3 d 2 
| Тригонально-призматическая | 
| ||
| spd 4, pd 5 | Тригонально-призматическая | ↑ | ||
| p 2 d 3 | Тригонально-антипризматическая | 
| ||
| sp 3 d 3 | Пентагонально-бипирамидальная | 
| XeF6, IF7, ZrF73- | |
| sp 3 d 4 | Кубическая | 
| PbF48- | |
| sp 3 d 4 | Тетрагонально-антипризматическая | 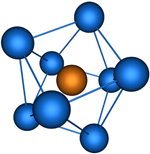
| TaF83-, Cs4[U(NCS)8] | |
| sp 3 d 4 | Додекаэдрическая | 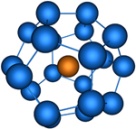
| K3[Cr(O2) 4], [Sn(NO3)4] |
13. Ионная связь. Механизм образования ионной связи. Отличия ионной связи от ковалентной.
Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому-паренеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую, но не нулевую, электроотрицательность, илюбая связь будет в некоторой степени ковалентной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящихся в состоянии разноименно заряженных ионов.
Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов. При отдаче электронов образуется положительно заряженный ион-катион, при присоединении-отрицательный-анион.
При отдаче или присоединении электронов молекулами образуются молекулярные или многоатомные ионы, например О2+ - катион диоксигенила, NO2- -нитрит-ион.
Одноатомные катионы и одноатомные анионы возникают при химической реакции между нейтральнами атомами путем взаимопередачи электронов. При этом атом электроположительного элемента, обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий большое число электроно на внешнем слое, переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов.
Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы-неметаллами. При передаче электронов металлического и неметаллического элементов стремятся сформировать вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает внешнюю оболочку последующего благородного газа, тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую конфигурацию предыдущего благородного газа.
Кулоновские силы притяжения, возникающие при взаимодействии заряженных ионов, сильные и действуют одинаково во всех направлениях. В результате этого расположение ионов упорядочивается в пространстве определенным образом, образуя ионную кристаллическую решётку. Вещества с ионной КР при обычных условиях находятся в кристаллическом состоянии, они имеют высокие температуры плавления и кипения.
14. Межмолекулярные взаимодействия и агрегатное состояние вещества. Водородная связь и ее виды.
взаимодействие, межмолекулярное (англ. intermolecular interaction) — взаимодействие между молекулами или атомами, не приводящее к образованию ковалентных (химических) связей.
Межмолекулярное взаимодействие имеет электростатическую природу. Предположение о его существовании было впервые использовано Я.Д. Ван-дер-Ваальсом (1873) для объяснения свойств реальных газов и жидкостей. В наиболее широком смысле под ним можно понимать такие взаимодействия между любыми частицами (молекулами, атомами, ионами), при которых не происходит образования химических, т. е. ионных, ковалентных или металлических связей. Иными словами, эти взаимодействия существенно слабее ковалентных и не приводят к существенной перестройке электронного строения взаимодействующих частиц.
Агрега́ тное состоя́ ние — состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств.[1].
Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазму. Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе — Эйнштейна.
Изменения агрегатного состояния это термодинамические процессы, называемые фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация; из жидкого в твёрдое — кристаллизация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию.
Водородная связь - это своеобразная химическая связь. Она может быть межмолекулярной и внутримолекулярной.
Межмолекулярная водородная связь возникает между молекулами, в состав которых входят водород и сильно электроотрицательный злемент - фтор, кислород, азот, реже хлор, сера. Поскольку в такой молекуле общая электронная пара сильно смещена от водорода к атому электроотрицательного элемента, а положительный заряд водорода сконцентрирован в малом объеме, то протон взаимодействует с неподеленной электронной парой другого атома или иона, обобществляя ее. В результате образуется вторая, более слабая связь, получившая название водородной.
Обычно водородную связь обозначают точками и этим указывают, что она намного слабее ковалентной связи (примерно в 15-20 раз). Тем не менее она ответственна за ассоциацию молекул. Например, образование димеров (в жидком состоянии они наиболее устойчивы) воды и уксусной кислоты можно представить схемами:
Как видно из этих примеров, посредством водородной связи объединены две молекулы воды, а в случае уксусной кислоты - две молекулы кислоты с образованием циклической структуры.
Водородная связь оказывает влияние на свойства многих веществ. Так, благодаря водородной связи фтороводород в обычных условиях существует в жидком состоянии (ниже 19, 5оС) и содержит молекулы состава от Н2F2 до Н6F6
Наличием водородных связей объясняется более высокая температура кипения воды (100оС) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те). В случае воды надо затратить дополнительную энергию на разрушение водородных связей.
Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, а потому эти связи играют важную роль в химии процессов жизнедеятельности.
15. Растворы. Теории образования растворов. Способы выражения концентрации растворов.
РАСТВОРЫ, гомогенные системы, состоящие из двух или более компонентов, состав к-рых в определенных пределах может непрерывно изменяться. От мех. смесей растворы отличаются своей однородностью и возрастанием энтропии системы при смешении компонентов. По агрегатному состоянию различают растворы газовые (газовые смеси), жидкие и твердые.
Существует две основные теории образования растворов (истинных). 1. Химическая теория образования растворов, сформулированная Дмитрием Ивановичем Менделеевым, по которой между растворителем и растворенным веществом происходят химические взаимодействия (химические реакции) с образованием особой группы веществ: сольватов, гидратов и кристаллогидратов. 2. Физическая теория образования растворов, которая рассматривает инертные растворы, где не происходят вышеуказанные взаимодействия
Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:
w(B)= m(B) / m
Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0, 06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается " M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
16. Теория электролитической диссоциации. Механизм электролитической диссоциации. Степень диссоциации. Сильные и слабые электролиты.
Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении. Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор.
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Теорию электролитической диссоциации создал в 18 Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами - к отрицательному полюсу. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гидратированные ионы. Диссоциация полярных молекул может быть полной или частичной.
Таким образом, электролитами являются соединения с ионной или полярной связью - соли, кислоты и основания. И диссоциировать на ионы они могут в полярных растворителях.
тепень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации α равна отношению числа диссоциированных молекул n к сумме n + N, где N — число недиссоциированных молекул. Часто α выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
- Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
- Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
17. Сильные и слабые электролиты. Константа диссоциации и ее взаимосвязь со степенью диссоциации. Определение рН растворов кислот и оснований.
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции 
где комплекс A x B y разбивается на x единиц A и y единиц B, константа диссоциации определяется так:

где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Исходя из определения степени диссоциации, для электролита КА в реакции диссоциации [A− ] = [K+] = α ·c, [KA] = c — α ·c = c·(1 — α), где α — степени диссоциации электролита.
Тогда: 
Это выражение называют законом разбавления Оствальда. При очень малых α (α < < 1) K=cα ² и
 ,
,
таким образом, при увеличении концентрации электролита степень диссоциации уменьшается, при уменьшении — возрастает. Подробнее связь константы диссоциации и степени диссоциации описана в статье Закон разбавления Оствальда.
18. Обменные реакции. Условия протекания обменных реакций, примеры.
19. Осмос. Осмотическое давление. Роль осмоса в биологических системах.
О́ смос (от греч. ὄ σ μ ο ς — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́ льшей концентрации растворённого вещества (меньшей концентрации растворителя). Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворенного вещества (см. Рис. 1). Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Например, к яичной скорлупе с внутренней стороны прилегает полупроницаемая мембрана: она пропускает молекулы воды и задерживает молекулы сахара. Если такой мембраной разделить растворы сахара с концентрацией 5 и 10 % соответственно, то через нее в обоих направлениях будут проходить только молекулы воды. В результате в более разбавленном растворе концентрация сахара повысится, а в более концентрированном, наоборот, понизится. Когда концентрация сахара в обоих растворах станет одинаковой, наступит равновесие. Растворы, достигшие равновесия, называются изотоническими.
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, перенос последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов.
20. Малорастворимые электролиты. Произведение растворимости.
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
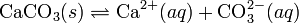
Константа этого равновесия рассчитывается по уравнению:

В приближении идеального раствора с учетом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:

Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:

где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
21. Ионное произведение воды, водородный показатель рН.
Вода является очень слабым электролитом: лишь незначительная часть молекул воды диссоциирует на ионы:
H2O ↔ H+ + OH¯
Экспериментально установлено, что произведение концентраций ионов H+ и OH¯ в воде и разбавленных водных растворах электролитов является величиной постоянной и называется ионным произведением воды (Kw)
Kw = [H+] + [OH¯ ] = 10-14,
[H+] = [OH¯ ] = 10-7 моль/л
Для удобства условились выражать кислотность раствора как отрицательный логарифм концентрации водородных ионов. Эту величину называют водородным показателем и обозначают pH.
pH = -lg[H+]
Аналогично, отрицательный логарифм концентрации гидроксильных ионов обозначают pOH, однако, пользуются этим показателем значительно реже.
pH + pOH = 14
В зависимости от соотношения концентраций ионов H+ и OH¯ различают три вида реакции среды:
кислая среда: [H+] > [OH¯ ]; [H+] > 10-7 моль/л; pH < pOH; pH < 7;
нейтральная среда: [H+] = [OH¯ ] = 10-7 моль/л; pH = pOH = 7;
щелочная среда: [H+] < [OH¯ ]; [H+] < 10-7 моль/л; pH > pOH; pH > 7;
Таким образом, значения pH всех водных растворов электролитов укладывается в шкалу pH от 0 до 14.
22.Гидролиз солей. Различные типы гидролиза. Ступенчатый гидролиз.
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей[1]:
- 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
CO32− + H2O = HCO3− + OH−
Na2CO3 + Н2О = NaHCO3 + NaOH
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
- 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
Cu2+ + Н2О = CuOH+ + Н+
CuCl2 + Н2О = CuOHCl + HCl
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
- 3. Гидролиз соли слабой кислоты и слабого основания:
2Al3+ + 3S2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ)
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
арсенит цинка Zn(AsO2)2
1 Zn(AsO2)2+H2O → ZnOHAsO2+HAsO2
Zn+H2O → ZnOH+H
2 ZnOHAsO2+H2O → Zn(OH)2AsO2+HAsO2
ZnOH+H2O→ Zn(OH)2+H
3 Zn(OH)2AsO2 +H2O→ Zn(OH)3AsO2 +HAsO2
Zn(OH)2+H2O→ Zn(OH)3+H
общее уравнение: Zn(AsO2)2+3H2O → Zn(OH)3AsO2 +3HAsO2
Zn+3H2O→ Zn(OH)3+3H
23. Взаимное усиление гидролиза. Гидролиз кислых и основных солей.
24. Количественные характеристики гидролиза: степень и константа гидролиза. Определение рН растворов гидролизующихся солей.
|
|