
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Застосування ацетилену
|
|
Поняття про синтетичний каучук та натуральний каучук
Синтетичний каучук - високополімерний, каучукоподібнийматеріал. Його отримують полімеризацією або сополимеризацией бутадієну, стиролу, ізопрену, хлорпрен, ізобутилену, нітрилу акрилової кислоти. Подібно натуральним каучуків, синтетичні мають довгі макромолекулярні ланцюга, іноді розгалужені, із середнім молекулярною вагою, рівним сотням тисяч і навіть мільйонів. Полімерні ланцюги в синтетичному каучуку в більшості випадків мають подвійні зв'язки, завдяки яким при вулканізації утворюється просторова сітка, що отримується при цьому гума, набуває характерні фізико-механічні властивості.
Каучук натуральний, полімер рослинного походження, вулканізацією якого отримують гуму. До. н. відноситься до групи еластомерів — високомолекулярних з'єднань, що володіють здібністю до великих оборотних деформацій при кімнатною і нижчих температурах (див. також Високоеластичний стан). До. н. міститься в молочному соку (латексі) каучуконосних рослин; окремі включення каучуку є також в клітках кори і листя цих рослин.
Застосування ацетилену
Головною галуззю застосування ацетилену є хімічна промисловість. Ацетилен служить вихідною сировиною для синтезу таких важливих хімічних продуктів, як пластмаси, бензол, ацетатна кислота і ін. У техніці значні кількості ацетилену використовуються при автогенному зварюванні і різанні металів.
16. Природні джерела вуглеводів
Вуглеводні, розглянуті раніше, є цінною сировиною для сучасної енергетики та хімічної промисловості. Основними джерелами вуглеводнів є природний та попутний нафтовий гази, нафта і кам’яне вугілля.
Головною складовою частиною природного газу є метан, частка якого може сягати до 97 %, крім нього газ містить також інші газоподібні леткі алкани – етан, пропан, бутан, ізобутан. Природний газ розділяють на компоненти шляхом зрідження та наступною фракційною перегонкою при низькій температурі під тиском.
Попутний нафтовий газ зустрічається над покладами нафти, складається з метану (біля 40%) та інших газів. Раніше попутний газ спалювали на місці видобування, а тепер, паралельно з природним газом, його використовують як хімічну сировину або екологічно чисте паливо (при горінні не утворюється попіл, а лише СО2 і Н2О).
17. Нафта, склад та властивості нафти
Нафта – масляниста, в’язка рідина темного кольору, з характерним “бензиновим” запахом, легша за воду і нерозчинна у ній. Поклади її розташовуються під землею або під морським дном. Утворилась нафта протягом мільйонів років з продуктів розкладу рослинних і тваринних решток під великим тиском у земній корі і тому є невідновним природним ресурсом.
За складом нафта — складна суміш вуглеводнів різної молекулярної маси, головним чином рідких (у них розчинені тверді й газоподібні вуглеводні). Зазвичай це вуглеводні парафінові, ароматичні, циклоалкани, співвідношення яких у нафтах різних родовищ змінюється в широких межах. Крім вуглеводнів, нафта містить оксигено-, сульфуро- і нітрогеновмісні органічні сполуки.
Продукти первинної перегонки нафти мають різне застосування.
• Бензин у великих кількостях використовують як авіаційне й автомобільне пальне. Він складається зазвичай з вуглеводнів, що містять у молекулах у середньому від п’яти до дев’яти атомів Карбону.
• Лігроїн є пальним для дизельних двигунів, а також розчинником у лакофарбовій промисловості. Велику кількість його переробляють на бензин.
• Гас застосовують як пальне для реактивних і тракторних двигунів, а також для побутових потреб. Він складається з вуглеводнів, що містять у молекулах у середньому від 9 до 16 атомів Карбону.
• Газойль — використовують як моторне пальне.
• Мазут, крім переробки на мастила й бензин, використовують як котельне рідке пальне.
18. Насичені одноатомні спирти. Фізичні властивості.
Добре розчиняються в полярних розчинниках, передусім воді. З нею вони змішуються в будь-яких співвідношеннях. Під час розчинення метанолу й етанолу між їхніми молекулами й молекулами води утворюються водневі зв'язки. Водночас ці спирти, завдяки наявності в їхньому складі неполярних залишків насичених вуглеводнів, розчиняються в слабополярних органічних розчинниках і самі є розчинниками для багатьох неорганічних і органічних речовин.
19. Насичені одноатомні спирти. Хімічні властивості.
зумовлені наявністю в їхньому складі залишку насиченого вуглеводню й функціональної гідроксильної групи. Спирти беруть участь у найрізноманітніших хімічних перетвореннях. При пропущенні парів метанолу через червоного напружену трубку виходить C2H2 та ін. Продукти (Бертло). При пропущенні парів метанолу над розжареним цинком виходить окис вуглецю, водень і невеликі кількості болотного газу (Jahn). Повільне окислення парів метанолу за допомогою розпеченої платинової або мідного дроту являє кращий засіб для отримання великих кількостей формальдегіду: 2СН3ОН + О2 = 2НСНО + 2Н2О. При дії хлористого цинку і високої температури метанол дає воду і алкани, а також невеликі кількості гексаметілбензола (Лебідь і Грін). Метанол, нагрітий з нашатирем в запаяній трубці до 300 °, дає моно-, ди-і триметиламіну (Бертло).20. Застосування спиртів
Спирти використовують як органічні розчинники, як паливо для двигунів. Їх використовують також для виробництва бутадієну, з якого в подальшому виготовляють синтетичний каучук, для добування низки фармацевтичних препаратів (медичного етеру, хлор етану тощо), а ще для добування оцтової кислоти та «фруктових есенцій». У майбутньому все більше й більше зростатиме значення метилового спирту для добування найрізноманітніших речовин, потрібних народному господарству. Метиловий спирт використовують для добування формальдегіду, потрібного для виробництва пластмас та феноло-формальдегідних смол і деяких етерів.
Етиленгліколь та пропінеленгліколь використовують при виготовлені антифризу для автомобілів, у виробництві розчинників, вони входять до складу гальмівної речовини.
21. Біологічна дія спиртів
Потрапляючи до тіла людини через стравохід, спирти швидко всмоктуються. У шлунку поглинається 20% початкового спирту, а у тонкому кишечнику — 80%. Після поглинання він потрапляє у кров уже за 5 хвилин, розповсюджуючись із кровотоком по всьому організму.
Центральна нервова система. Спирт пригнічує функції ЦНС подібно до інших анестезуючих речовин..
Хронічне вживання спирту спричинює дефіцит серотоніну. Функціональне зниження активності цієї системи перешкоджає розвитку толерантності і, навпаки, збільшення її активності, підвищення рівня серотоніну прискорюють розвиток толерантності до алкоголю. Під дією спиртів порушується обмін дофаміну, котрий бере участь у синтезі норадреналіну і координує рухи, емоційний та психічний стани. Також спирти чинять негативний вплив на фізичні і психічні можливості: вони знижують гостроту зору та слуху, порушують м'язову координацію і стійкість, уповільнюють час реакції на подразнення.
Дихальна система. Спирти мають яскраво виражену токсичну дію на органи дихання. Ураження легень позначається розвитком бронхолегеневої інфекції внаслідок зменшення захисних функцій організму.
22. Багатоатомні спирти. Хімічні властивості
Багатоатомні спирти - органічні сполуки класу спиртів, що містять в своєму складі більше однієї гідроксильної групи. Особливе значення поліспирти мають в двох областях: харчової промисловості та хімії полімерів.
Хімічні властивості багатоатомних спиртів включають в себе всі хімічні властивості одноатомних спиртів. Також поліспирти реагують з нерозчинними підставами. Наприклад, гліцерин реагує з гідроксидом міді в присутності лугу з утворенням яскраво - блакитного з'єднання (гліцерат міді). В аналогічну реакцію вступає і етиленгліколь. Реакція з гідроксидом міді є якісною реакцією на багатоатомні спирти.
23. Якісна реакція на багатоатомні спирти
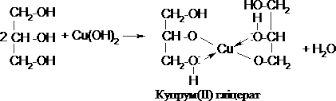
найбільш відома якісна реакція на багатоатомні спирти - взаємодія їх з гідроксидом міді (II). Гідроксид розчиняється, утворюється хелатний комплекс темно-синього кольору. На відміну від альдегідів багатоатомні спирти реагують з гідроксидом міді (II) без нагрівання.
24. Реакція нітрування багатоатомних спиртів

25. Феноли фізичні властивості
Фенол являє собою безбарвні кристали (в ідеалі), при зберіганні набуває рожевуватого забарвлення внаслідок часткового окиснення. Має специфічний стійкий запах. Отруйний! При потраплянні на шкіру викликає хімічний опік. Температура плавлення +42 градуси. Фенол дуже погано розчиняється в холодній воді, але дуже добре розчиняється в гарячій.
26. Застосування фенолів.
Колись фенол уважали одним з найважливіших антисептиків і широко використовували для дезінфекції приміщень, меблів, хірургічних інструментів. Дотепер збереглася тривіальна назва фенолу – карбонова кислота. Зараз фенол рідко виступає в ролі антисептика, його замінили інші речовини. Натомість усе більше зростає роль фенолу в синтетичній промисловості. З фенолу добувають капролактам, який застосовують для виробництва пластмас та синтетичного капронового волокна, разом з формаліном із нього добувають феноло-формальдегідні смоли.
27. Порівняйте властивості етанолу і фенолу
28. Альдегіди, їх фізичні властивості.
Альдегіди – клас органічних сполук, у яких карбонільна група СО зв'язна з атомом та органічним радикалом R. Загальна формула – СnH2n+1CHO
Альдегіди – безбарвні речовини з характерним запахом. Перший член гомологічного ряду альдегідів – формальдегід – при звичайних умовах є газуватою речовиною (на відміну від спиртів)
29. Запишіть перших п’ять представників гомологічного ряду альдегідів. Вкажіть їх структурні формули.
Метаналь (формальдегід, мурашиний альдегід)

Етаналь (Ацетальдегід, оцтовий альдегід)

Пропаналь (Пропіновий альдегід)
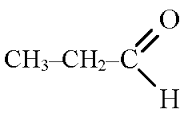
Бутаналь (Масляний альдегід)

Пентаналь (Валеріановий альдегід)
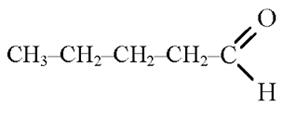
30. Якісна реакція на альдегіди

31. Альдегіди, їх застосування
Найбільш поширеними серед альдегідів є формальдегід та ацетальдегід
Формальдегід
Застосовують у виробництві термореактивних пластмас, феноло – формальдегідних та сечовино – формальдегідних смол. Формальдегід є біологічно активною речовиною: під його впливом відбувається згортання білка. У медицині також використовують похідні формальдегіду – уротропін.
Ацетальдегід
Найважливіші застосування оцтового альдегіду ґрунтуються на використанні його реакцій окиснення та відновлення. За допомогою першої з них добувають оцтову кислоту, за допомогою другої у деяких країнах – етиловий спирт. Основне застосування оцтового альдегіду – добування оцтової кислоти. Інші альдегіди в промисловості застосовують не так часто. Деякі альдегіди, які мають приємний запах, використовують у парфумерії та косметиці.
32. Поняття про карбонові кислоти
Оскільки органічні кислоти, так само, як і решта органічних сполук, мають у своєму складі вуглеводневий кістяк, то всі органічні кислоти називають карбоновими кислотами. Карбонові кислоти належать до оксигенвмісних органічних сполук і мають у своєму складі функціональну групу, що визначає їхню приналежність до кислот.
У кислот функціональна група поєднує в собі карбонільну та гідроксильну групи – СООН. Цю групу називають карбоксильною групою.
33. Фізичні властивості карбонових кислот
На відміну від альдегідів, уже перший член ряду – мурашина кислота – рідина з досить високою температурою кипіння, початкові члени ряду мають різкий запах, пропанова має запах поту, запах масляної кислоти відчувається при підгоранні їжі на сковороді. Запах інших рідких кислот так само неприємний. Карбонові кислоти із числом атомів Карбону більшим від 10 є твердими речовинами.
34. Хімічні властивості карбонових кислот.
1) Вплив кислот на індикатори за рахунок дисоціації на йони:
СН3СООН ˭ СН3СОО +Н2
2) Взаємодія з металами:
Zn+2CH3COOH- Zn(CH3COO)2+H2
3) Взаємодія з оксидами металів:
MgO+2CH3COOH-Mg(CH3COO)2+H2O
4) Взаємодія з лугами
CH3COOH+NaOH- CH3COONa+ H2O
|
|