
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Державний контроль якості лікарських засобів під час оптової та роздрібної торгівлі
|
|
Під час інспектування суб’єктів господарювання державні інспектори територіальних інспекцій на місці здійснюють перевірку додержання вимог законодавства щодо забезпечення якості лікарських засобів та вибірковий візуальний контроль лікарських засобів відповідно до підпунктів 2.3.4 та 3.3.4.
Лікарські засоби, що пройшли вхідний контроль уповноваженими особами і перебувають у процесі зберігання та торгівлі, підлягають вибірковому відбору інспектором, що проводить перевірку, для виконання лабораторного аналізу, який здійснюється: за планами інспектувань (1 раз на рік); за окремими завданнями Держлікслужби України чи територіальних інспекцій; на підставі звернень місцевих органів державної влади, органів самоврядування або правоохоронних органів щодо проведення перевірки; за скаргами споживачів про якість лікарських засобів.
Відбору підлягають у першу чергу лікарські засоби, що виготовляються (в умовах аптеки), зберігаються, транспортуються та реалізуються з порушенням діючих норм і правил, та в разі виникнення сумніву щодо якості препаратів.
Кількість упаковок, які відбираються для проведення лабораторного контролю, повинна бути достатньою для проведення трьох повних аналізів (але не менше двох упаковок) за показниками якості, що перевіряються, згідно з відповідною АНД. Відбір зразків лікарських засобів для лабораторного контролю оформляють актом (додаток 3).
Лабораторний контроль якості лікарських засобів здійснюється підпорядкованими або уповноваженими лабораторіями на підставі направлень Держлікслужби України або територіальних інспекцій чи на підставі звернень суб’єктів відповідно до договорів, укладених між територіальними інспекціями або уповноваженими лабораторіями та суб‘єктами.
Крім загальних показників якості, що контролюються («Опис», «Упаковка», «Маркування», по змозі — ідентифікація), для одержання об’єктивного висновку щодо якості лікарського засобу перевіряються додаткові показники якості:
Аерозолі — перевірка упаковки на герметичність, визначення середньої маси препарату в одній дозі, визначення відсотка виходу вмісту упаковки.
Гранули — розмір, розпад, вміст вологи, маса вмісту упаковки.
Капсули — визначення середньої маси, середньої маси вмісту капсул, відхилення від середньої маси, розпад.
Мазі — однорідність, номінальна маса, рН (за вказівки останнього показника в АНД), маса вмісту упаковки.
Настойки — вміст спирту, об’єм умісту флакона (чи іншої упаковки згідно з АНД), сухий залишок, важкі метали.
Супозиторії — визначення середньої маси, відхилення від середньої маси, температура топлення (час розчинення).
Суспензії — маса (об’єм) умісту упаковки, рН.
Таблетки — час розпаду, середня маса, відхилення від середньої маси.
Екстракти — вміст спирту, маса вмісту упаковки, важкі метали, сухий залишок, вміст вологи.
Сироп — маса (об’єм) вмісту упаковки, рН, питома вага, кількісний вміст цукру (при вказівці останнього показника в АНД).
Ін’єкційні лікарські форми, очні краплі підлягають перевірці згідно з вимогами АНД на тотожність, колірність, прозорість, рН розчину, номінальний об’єм, відсутність у них механічних включень (останній показник виконується тільки за наявності необхідної кількості зразка лікарського засобу згідно з номативною документацією).
Кожну серію лікарської рослинної сировини «ангро» і в розфасованому вигляді (незалежно від заводу — виробника, заготівника та постачальника) контролюють на тотожність (ідентичність), здрібнювання, ефірні олії, рН (за наявності останнього показника в АНД), вміст вологи, наявність домішок, зараження амбарними шкідниками, вміст радіонуклідів. Брикети, крім того, перевіряються на міцність та розпад.
17) Спектрофотометрія у видимій області і УФ-областях дозволяє оцінювати ступінь чистоти речовини, ідентифікувати по спектру різні сполуки, визначити константи дисоціації кислот і основ, досліджувати процеси комплексоноутворення.
Інфрачервоні (ІЧ) спектри дають характеристику речовин. Наявність в ІЧ-спектрах тих чи інших полос поглинання дозволяє розшифровувати структуру речовини.
УФ-спектрофотометричне вимірювання проводять в розчинах. Як розчинники використовують очищену воду, кислоти, луги, спирти (метанол, етанол), деякі інші органічні розчинники. Розчинник не повинен поглинатися в тій чи іншій області спектра, що й аналізуюча речовина. Характер спектра (структура і положення полос поглинання) може змінюватися в різних розчинниках, а також при зміні рН середовища.
Методом УФ-спектрофотометрії використовують для визначення ідентичності, чистоти і кількісного вмісту лікарських препаратів.
Вивчення спектрів поглинання хімічних речовин з різною структурою дало можливість установити, що основними факторами, які обумовлюють поглинання світла, є наявність так званих хромофорів, ненасиченість (подвійні чи потрійні зв’язки), наявність карбонільної, карбоксильної, амідної, азо-, нітрозо-, нітро- та інших функціональних груп. Кожна функціональна група характеризується поглинанням в певній області спектра. Але є ряд факторів (присутність декількох хромофорних груп, вплив розчинника та ін.) приводять до зміщення смуг поглинання в сторону більших довжин хвиль (багатохромне зміщення) або в сторону коротких довжин хвиль (гіпсохромне зміщення). Крім зміщення може спостерігатися ефект збільшення (гіперхромний) чи зменшення (гіпохромний) інтенсивності поглинання.
В зв’язку з цим для ідентифікації речовин по її УФ-спектру застосовують метод порівняння із спектром відомої речовини, одержаний в тих же умовах. Характеристикою спектра поглинання речовини є положення максимумів (мінімумів) поглинання, а також інтенсивність поглинання, що характеризується величиною густини чи питомого показника поглинання при даній довжині хвилі.
Інфрачервоні (коливальні) спектри використовуються для ідентифікації лікарських препаратів. ІЧ-спектри більшості органічних сполук на відміну від УФ-спектрів характеризуються наявністю великою кількістю ліків поглинання. Метод ІЧ-спектроскопії дає можливість одержати найбільш повну інформацію про будову і склад аналізуємої речовини, яка дозволяє ідентифікувати дуже близькі по структурі сполуки. Метод інфрачервоної спектроскопії прийнятий для ідентифікації органічних лікарських речовин з полі функціональними групами шляхом порівняння із спектрами стандартних зразків, які зняті в однакових умовах.
У зв’язку з підвищеними вимогами до якості лікарських речовин ІЧ-спектроскопія, як один із найбільш надійних методів ідентифікації, набуває все більшого значення. Спектрофотометричне визначення проводять спектрофотометром як забарвлених, так і безбарвних сполук по вибірковому поглинання світла у видимій, ультрафіолетовій чи інфрачервоній областях спектра.
Спектрофотометричний метод аналізу ґрунтується на загальному принципі – пропорціональній залежності між світло поглинанням речовини, її концентрації і товщини поглинаючого шару. Для визначення концентрації розчинів спектрофотометричним методом використовують закон Бугра-Ламберта-Беєра:
18) онкошарова хроматографія (рос. тонкослойная хроматография, англ. thin-layer chromatography; нім. Dü nnschichtchromatographie f) – метод розділення і аналізу сумішей речовин, що базується на їх різній сорбованості тонким шаром сорбенту (нерухомою фазою) при руху по ньому розчинника (рухомої фази). Як нерухома фаза використовується силікагель, оксид алюмінію, кизельгур, целюлоза, поліамідні матеріали, йонообмінні синтетичні смоли, мінерально-органічні йоніти, як рухома фаза – органічні розчинники (напр., спирти, кетони, феноли, їх суміші). Методи Т.х. дозволяють розділяти та ідентифікувати речовини в кількостях 10-9-10-6 г, виконувати аналізи з наважок до 10-6 г. Використовують при якісному аналізі мінералів. Особливо цінне застосування Т.х. при аналізі руд і мінералів з близькими хім. властивостями, напр. рідкісноземельних елементів, цирконію і гафнію, ніобію і танталу та інш.
19) Газовая хроматография — разновидность хроматографии, метод разделения летучих компонентов, при котором подвижной фазой служит инертный газ (газ-носитель), протекающий через неподвижную фазу с большой поверхностью. В качестве подвижной фазы используют водород, гелий, азот, аргон, углекислый газ. Газ-носитель не реагирует с неподвижной фазой и разделяемыми веществами.
Различают газо-твёрдофазную и газо-жидкостную хроматографию. В первом случае неподвижной фазой является твёрдый носитель (силикагель, уголь, оксид алюминия), во втором — жидкость, нанесённая на поверхность инертного носителя.
Газо-жидкостная хроматография — разделение газовой смеси вследствие различной растворимости компонентов пробы в жидкости или различной стабильности образующихся комплексов. Неподвижной фазой служит жидкость, нанесенная на инертный носитель, подвижной — газ.[1]
Разделение основано на различиях в летучести и растворимости (или адсорбируемости) компонентов разделяемой смеси.
Этот метод можно использовать для анализа газообразных, жидких и твёрдых веществ с молекулярной массой меньше 400, которые должны удовлетворять определённым требованиям, главные из которых — летучесть, термостабильность, инертность, лёгкость получения. Этим требованиям в полной мере удовлетворяют, как правило, органические вещества, поэтому газовую хроматографию широко используют как серийный метод анализа органических соединений.
20) Ці залежності є основою потенціометричних методів аналізу ― прямої потенціометрії та потенціометричного титрування.
Аналітичним сигналом методу є значення величини потенціалу.
Оскільки значення потенціалу залежить не тільки від природи речовини, а й від її концентрації, тому потенціометричні методи не можуть бути використані для якісного аналізу.
В основі кількісного аналізу лежить лінійна залежність потенціалу електрода від логарифма концентрації (активності) аналізованої речовини, або логарифма відношення концентрацій (активностей) окисненої і відновленої форми цієї речовини.
Метод прямої потенціометрії оснований на вимірюванні точного значення електродного потенціалу і обчисленні концентрації визначуваних іонів. Пряма потенціометрія широко використовується для визначення концентрації водневих іонів в розчині за допомогою скляного індикаторного електрода та хлоридно-срібного електрода порівняння. Електрорушійна сила (ЕРС) такої комірки описується формулою:
 . (1.3)
. (1.3)
Метод потенціометричного титрування ― це титриметричний метод аналізу, в якому точку еквівалентності визначають за зміною потенціалу індикаторного електрода в процесі титрування визначуваної речовини стандартним розчином відповідного реаґенту. Точка еквівалентності характеризується різкою зміною (стрибком) потенціалу.
Потенціометричне титрування можна використати для аналізу мутних і забарвлених розчинів, слабких і дуже слабких кислот та основ, суміші кислот та основ різної сили, солей, багатоосновних кислот.
Переваги методу: висока точність, добра відтворюваність результатів, різка зміна потенціалу індикаторного електрода біля точки еквівалентності, відсутність індикаторної похибки, можливість титрування розбавлених розчинів та визначення кількох компонентів в суміші без розділення.
При потенціометричних вимірюваннях у досліджуваний розчин опускають два електроди ― індикаторний і порівняння, які з’єднують з приладом ― потенціометром, іономіром або рН-метром.
Індикаторні електроди ― це електроди, значення потенціалу яких залежить від концентрації (активності) визначуваної речовини, або від відношення концентрацій (активностей) окисненої і відновленої форм цієї речовини. Індикаторні електроди вибирають залежно від типу реакції та природи визначуваної речовини.
У окисно-відновних реакціях використовують індиферентні платиновий або золотий електроди, які чутливі до зміни концентрації окисненої та відновленої форми досліджуваної речовини.
У реакціях нейтралізації використовують скляний, водневий або хінгідронний електроди, які чутливі до зміни концентрації іонів водню.
Іоноселективні електроди мають високу специфічність до окремих іонів (Cl–, Br–, I–, F–, NO3–, S2–, CN–, SCN–, PO43–, CO32–, NH4+, K+, Na+, Li+, Ca2+, Sr2+, Ba2+, Cu2+, Fe2+, Fe3+) і використовуються для їх визначення.
В реакціях осадження та комплексоутворення найчастіше використовують металеві електроди із срібла і ртуті, які призначені для визначення концентрації Ag+, Hg2+, Cl–, Br–, I–, CN–.
Електроди порівняння (стандартні електроди) ― це електроди, які мають відоме і постійне значення потенціалу при постійній температурі. Всі ці електроди є електродами другого роду, які містять метал в контакті з його малорозчинною сіллю, занурений в розчин електроліту з аніоном малорозчинної солі більшої концентрації. Найчастіше використовують насичений каломельний Hg, Hg2Cl2 | KCl || (рис. 3а) та хлоридно-срібний Ag, AgCl | KCl || (рис. 3б) електроди, які мають високу відтворюваність і є компактними.
12) РЕФРАКТОМЕТРИЧНИЙ МЕТОД АНАЛІЗУ
Рефрактометричний метод аналізу заснований на вимірюванні показника заломлення (n) речовини, що досліджується. При переході променя світла з одного оптично прозорого середовища в інше вія змінює свій первісний напрямок, тобто заломлюється.
Застосування рефрактометри в якісному аналізі
Величину показника заломлення використовують в якісному аналізі
Для:
- ідентифікації речовин;
- визначення чистоти та тотожності речовин.
Застосування рефрактометрії в кількісному аналізі
Залежність показника заломлення від концентрації речовин в розчині покладена в основу кількісних визначень рефрактометричним методом і використовується для:
• визначення якості приготовлених розчинів та термінів зберігання
концентрованих розчинів;
• кількісного визначення компонентів в дво- та багатокомпонентних
сумішах.
Абсолютний показник заломлення — це відношення швидкості поширення світла у вакуумі до швидкості поширення світла в речовині, що досліджується. На практиці визначають так званий відносний показник заломлення — відношення швидкості поширення світла в повітрі до швидкості поширення світла в речовині.
22) ПОЛЯРИМЕТРІЯ — метод якісної та кількісної оцінки оптично-активних речовин, який ґрунтується на вимірюванні кута обертання площини поляризації прямолінійно поляризованого світла. Відхилення площини поляризації від початкового положення, яке виражається у кутових градусах, називають кутом обертання й позначають α. Його величина залежить від природи речовини, концентрації розчину, природи розчинника, товщини шару, довжини хвилі світла і температури. Від природи речовини залежить також напрям обертання площини поляризації (правообертаючі, лівообертаючі оптично-активні речовини).
Порівняльну оцінку можливості речовин обертати площину поляризації здійснюють за допомогою величин питомого обертання. Питоме обертання — це обертання площини поляризації, яке спричинене шаром речовини товщиною 1 дм при перерахуванні у вміст 1 г речовини в 1 мл об’єму. Зазвичай питоме обертання визначають за температурою 20 ˚ С, використовуючи світло з довжиною хвилі лінії D спектра натрію (589, 3 нм). При цьому питоме обертання позначають [α ]20D.
Питоме обертання для розчинів речовин визначають за формулою:
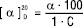 ,
,
де α — кут обертання в градусах; l — товщина шару розчину в дециметрах і C — концентрація речовини в г/100 мл розчину.
Для індивідуальних рідких речовин питоме обертання визначають за формулою:
 ,
,
де ρ — густина речовини.
Величина питомого обертання часто залишається сталою тільки у певному інтервалі концентрації. Тому необхідно зазначати, при якій концентрації речовини здійснювали визначення питомого обертання. Знаючи величину й інтервал концентрацій, в якому ця величина постійна, після визначення кута обертання α розчину, який досліджується, можна розрахувати концентрацію цього розчину — С — за формулою:
 .
.
Концентрацію речовини у розчині можна також визначити, використовуючи градуювальний графік, який побудований за координатами α — С. Вимірювання кута α здійснюють за допомогою приладів, які називають поляриметрами. Основними вузлами поляриметра є поляризатор й аналізатор. Перший служить для перетворення природного світла на поляризоване, а другий — для визначення положення площини поляризації. Між поляризатором й аналізатором розміщують трубку із розчином, який досліджується. Аналізатор зв’язаний з диском (лімбом) зі шкалою, яка поділена на 360 кутових градусів. Величину кута α зазвичай відраховують з точністю до 0, 01˚.
Метод використовується для визначення концентрації головним чином цукру, глюкози у водяних розчинах, а також деяких інших оптичних активних речовин, напр. алкалоїдів, етерних олій. У фармацевтичному аналізі його використовують, щоб підтвердити оптичну чистоту речовини, для її ідентифікації й кількісного визначення.
23) Вода очищена може бути отримана дистиляцією, іонним обміном, електролізом, зворотним осмосом. Якість води очищеної регламентується ФС 42-2619-89: вона повинна бути безбарвною, прозорою, без запаху і смаку; рН може коливатися в межах 5, 0-7, 0; не повинна містити відновлюючих речовин, нітратів, нітритів, хлоридів, сульфатів, слідів аміаку та інших домішок.З методів одержання води очищеної найпоширенішим є метод дистиляції (перегонки). Перегонка води повинна проводитися згідно з наказом МОЗ України № 139 від 14.06.93 р. у спеціально обладнаному для цього приміщенні (дистиляційній). Стіни приміщення повинні бути пофарбовані олійною фарбою або викладені лицювальною плиткою і утримуватися в абсолютній чистоті. У цих приміщеннях забороняється робити інші роботи - мити брудний посуд, прати білизну, зберігати сторонні предмети. Як виняток може бути дозволена тільки стерилізація розчинів лікарських речовин.На якість води очищеної впливає вихідний склад питної води, конструктивні особливості аквадистиляторів, а також умови збору і зберігання води. Для одержання води очищеної в містах, звичайно використовують водопровідну воду, яка відповідає санітарним вимогам, установленим для питної води. Що стосується води, використовуваної сільськими аптеками (криничної, річкової і т.п.), то вона потребує попередньої водопідготовки, оскільки звичайно містить як розчинені, так і механічні, і колоїдно-суспендовані домішки: органічні речовини, аміак, солі, що надають воді твердості, та інші речовини. Способи очищення залежать від характеру домішок, що містяться у воді.
Механічні домішки зазвичай відокремлюють відстоюванням з наступним зливанням води з осаду (декантацією) чи фільтруванням. Для цього використовують фільтри, виконані у вигляді ємності циліндричної форми, заповнені антрацитом чи кварцовим піском. Ємності мають кришку і дно, оснащене пристроєм для введення, виведення і розподілу води усередині фільтра. Фільтри можуть бути одношарові (наприклад, тільки шар антрациту) чи двошарові (антрацит і кварцовий пісок). Висота завантаження коливається в залежності від кількості суспендованих часток і бажаного промивного ефекту.
Руйнування органічних домішок. Перед дистиляцією до 100 л води, яка містить органічні домішки, додають у вигляді розчину 2, 5 г калію перманганату (або 1% розчин калію перманганату 25 мл на 10 л води), перемішують і залишають стояти на 6-8 годин. Активний кисень, що виділяється, окисляє органічні речовини:
2KMO4+H2O=2KOH+2MO2+3O
Потім воду зливають і фільтрують.
|
|