
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Водневий показник рН
|
|
Вода є досить слабким електролітом. Спрощена схема дисоціації молекул
води, якою часто користуються, має вигляд:
Н2О  Н+ + ОН-.
Н+ + ОН-.
Іон гідрогену Н+ не може окремо існувати у водному розчині, оскільки він сильно гідратований – взаємодіє з молекулами води з утворенням іонів гідроксонію Н3О+. Тому рівняння дисоціації води можна записати таким чином:
2Н2О  Н3О+ + ОН-.
Н3О+ + ОН-.
Тоді вираз для константи дисоціації води має вигляд:
 .
.
Причому, у чисельнику – добуток рівноважних концентрацій іонів, а у знаменнику – рівноважна концентрація води. Оскільки вода дисоціює досить погано, вважають, що її рівноважна концентрація [H2O] практично не відрізняється від початкової молярної концентрації C(H2O), яку можна визначити таким чином:
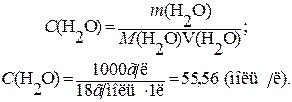
Отже, C (H2O)» [H2O] = 55, 56 моль/л.
Кондуктометрично (методом вимірювання електропровідності) було визначено ступінь дисоціації води при 298, 15 К ( = 1, 8 × 10-9).
= 1, 8 × 10-9).
Тоді константа дисоціації води при 298, 15 К 
 = a2 С;
= a2 С;
 = (1, 8 × 10-9)2 × 55, 56 = 1, 8 × 10-16 (моль/л),
= (1, 8 × 10-9)2 × 55, 56 = 1, 8 × 10-16 (моль/л),
а йонний добуток води (константа автоіонізації води) при 298, 15 К:
 = [Н+][ОН-] =
= [Н+][ОН-] =  [Н2О];
[Н2О];
 = 1, 8 × 10-16 × 55, 56 = 1, 0 × 10-14 (моль2/л2)
= 1, 8 × 10-16 × 55, 56 = 1, 0 × 10-14 (моль2/л2)
Отже,
 = [Н+][ОН-] = 1, 0 × 10-14 ( моль2/л2). (15.4)
= [Н+][ОН-] = 1, 0 × 10-14 ( моль2/л2). (15.4)
Згідно з формулою (15.4), у чистій воді чи в будь-якому водному розчині при постійній температурі добуток концентрацій іонів гідрогену Н+ та гідроксильних іонів ОН- є сталою величиною, яку називають іонним добутком води.
Знаючи 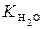 , можна визначити рівноважні молярні концентрації гідроксильних іонів та іонів гідрогену за формулами:
, можна визначити рівноважні молярні концентрації гідроксильних іонів та іонів гідрогену за формулами:
[ОН-] =  ; (15.5)
; (15.5)
[Н+] =  . (15.6)
. (15.6)
Зазначимо, що процес дисоціації води є ендотермічним, тобто відбувається з
поглинанням теплоти (D H 0дис = 57, 3 кДж/моль). Іонний добуток води (константа автоіонізації води) залежить від температури: з підвищенням температури він трохи збільшується. Однак при температурах, близьких до кімнатної, можна вважати  = 1, 0 × 10-14 моль2/л2.
= 1, 0 × 10-14 моль2/л2.
У нейтральному середовищі концентрації іонів Н+ і ОН- однакові, тобто [Н+] = [ОН-] = 10-7 моль/л. У кислих розчинах [Н+] > [ОН-], тоді як у лужних [Н+] < [ОН-]. Тому кислотність та лужність розчину кількісно можна характеризувати концентрацією одного з цих іонів.
Для характеристики кислотності середовища датський біохімік С. Серен-сен (1909 р.) запропонував використовувати водневий показник рН, який дорівнює десятковому логарифму концентрації іонів гідрогену, взятому з протилежним знаком:
рН = -lg[H+] (15.7)
Тоді
[Н+] = 10-рН. (15.8)
Аналогічно гідроксильний показник рОН визначають за формулою,
рОН = -lg[ОH-]; (15.9)
[ОН-] = 10-рОН (15.10)
Для розбавлених розчинів при температурі близько 20…25 °С виконується умова:
рН + рОН = 14. (15.11)
Для точних вимірювань рН розчинів зазвичай використовують рН-метри.
|
|