
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Приклади розв’язання типових задач з теми 11
|
|
Задача 1. Запишіть математичні вирази швидкостей прямого та зворотного процесів: 2СО(г) + О2(г)  2 СО2(г).
2 СО2(г).
Як зміниться швидкість прямої реакції, якщо тиск у системі збільшити у 3 рази?
Розв’язання. Згідно із законом діючих мас (формула (11.1)), вираз швид-кості прямої реакції має вигляд
v пр = k пр С 2(СО) С (О2),
де k пр - константа швидкості прямої реакції.
Швидкість зворотної реакції
v зв= k зв С 2(СО2),
де k зв - константа швидкості зворотної реакції.
Позначимо концентрації вихідних речовин до зміни тиску в системі:
С (СО) = а; С (О2) = b.
Тоді v пр = k пр а2b.
Згідно з рівнянням Менделєєва - Клапейрона
pV = nRT, (11.2)
де n = C (Х) V - кількість молів газу; С (Х) - молярна концентрація, моль/л;
R - універсальна газова стала (R = 8, 31Дж/(моль·К)).
Підвищення тиску приводить до пропорційного збільшення концентрації кожного з газоподібних компонентів. Таким чином, після підвищення тиску в системі концентрація вихідних речовин становитиме:
С ΄ (СО) = 3 а; С ΄ (О2) = 3 b.
Тоді швидкість прямої реакції
v ΄ пр = k пр (3 а)2 3 b = 27 k пр а 2 b;
 .
.
Отже, з підвищенням тиску у три рази швидкість прямої реакції збільшиться у 27 разів.
Задача 2. У скільки разів і як зміняться швидкості прямої та зворотної реакцій у системі
2SO2(г) + O2(г)  2SO3(г),
2SO3(г),
якщо об’єм газової суміші збільшити у п’ять разів? У який бік зміститься рівновага у системі?
Розв’язання. Позначимо тиск газоподібних речовин до зміни об’єму системи:
р (SO2) = a; р (О2) = b; р (SO3) = d.
Тоді згідно із законом діючих мас (формула (11.1)), швидкості прямої та зворотної реакцій становлять:
v пр = k пр а 2 b; v зв = k зв d 2.
Після збільшення об’єму гомогенної системи у п’ять разів тиск кожної з газоподібних речовин зменшиться теж у п’ять разів (формула (11.2)), тобто
р ΄ (SO2) = (1/5) a; р ΄ (О2) = (1/5) b; р ΄ (SO3) = (1/5) d.
Тоді швидкості прямої та зворотної реакцій становитиме
v ¢ пр = k пр 
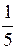 b =
b =  k пр а 2 b;
k пр а 2 b;
v ¢ зв = k зв  =
= 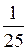 k зв d 2.
k зв d 2.
Звідси
 ;
;
 .
.
Отже, швидкість прямої реакції зменшиться у 125 разів, а зворотної - тільки в 25 разів. При цьому рівновага у системі зміститься у бік зворотної реакції.
Задача 3. Обчисліть, у скільки разів збільшиться швидкість гомогенної реакції, яка проходить у газовій фазі, якщо температура зросте від 30 до 70 °С, якщо температурний коефіцієнт швидкості реакції дорівнює двом.
Розв’язання. Математичний вираз правила Вант-Гоффа має вигляд
 g = 2…4,
g = 2…4,
де g - температурний коефіцієнт швидкості реакції.
Якщо темпepатура змінюється на (n 10)°, то
 або
або  . (11.3)
. (11.3) 
Швидкість реaкції зростатиме зі збільшенням температури у стільки разів, у скільки зросте константа швидкості даної реакції. Для цієї реакції (враховуючи, що D Т = D t):
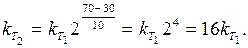 |
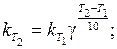
Отже, з підвищенням температури на 40 °С швидкість даної реакції збільшиться у 16 разів.
Задача 4. Для деякої хімічної реакції константи швидкості при температурах 298 і 338 К дорівнюють k 298 = 0, 01 і k 338 = 0, 4 відповідно. Обчисліть температурний коефіцієнт швидкості реакції, константу швидкості при температурі 310 К та енергію активації цієї реакції.
Розв’язання. Температурний коефіцієнтшвидкості реакції g можна визначити за формулою (11.3) після логарифмування:
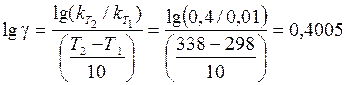 ; g = 2, 51.
; g = 2, 51.
Визначаємо константу швидкості реакції при температурі 310 К (Т 3):

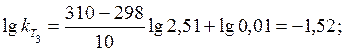
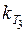 = 10-1, 52 = 0, 03.
= 10-1, 52 = 0, 03.
За значеннями констант швидкості реакції при будь-яких двох температурах можна розрахувати енергію активації ЕА реакції за рівнянням Арреніуса:
 ; (11.4)
; (11.4)

 (11.5)
(11.5)
Задача 5. Обчисліть, у скільки разів зменшиться швидкість деякої реакції під час зниження температури від 373 до 323 К, якщо енергія активації реакції становить 125, 61 кДж/моль.
Розв’язання. Залежність константи швидкості реакції від температури описують формулою (11.4):

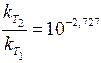
 .
.
Отже, зі зниженням температури з 373 до 323 К швидкість реакції зменшиться у 534 рази.
Задача 6. З підвищенням температури з 298 до 398 К швидкість гетеро-генного процесу збільшилась у 25 000 разів. Обчисліть енергію активації реакції та визначіть, яка стадія процесу є лімітуючою: кінетична чи дифузійна.
Розв’язання. З рівняння Арреніуса (формула (11.5))

Відомо, що для кінетичних процесів (лімітуючою стадією є хімічна взаємодія) g лежить у межах 2…4, а EA = 50…200 кДж/моль; тоді як для дифузійних процесів g = 1, 1…1, 4, а EA = 5…20 кДж/моль. Обчислене значення енергії активації вказує на те, що лімітуючою стадією даного гетерогенного процесу є хімічна взаємодія.
Задача 7. Константа рівноваги реакції, поданої рівнянням:
CO(г) + H2O(г)  СО2(г) + Н2(г)
СО2(г) + Н2(г)
при 850 °С дорівнює одиниці (K р = 1). Визначіть рівноважні концентрації усіх речовин, якщо вихідні концентрації реагуючих речовин становлять
С вих(СО) = 3 моль/л; С вих(Н2О) = 2 моль/л.
Розв’язання. Узагальномувиглядідляреакції
aA + bB  eE + dD,
eE + dD,
де всі речовини - гази, математичний вираз константи рівноваги має вигляд:
 ,
,
де [ А ], [ В ], [ Е ], [ D ] - рівноважні молярні концентрації речовин, моль/л.
Запишемо закон діючих мас для прямої та зворотної реакцій:
v пр = k пр С (СО) С (Н2О); v зв = k зв С (СО2) С (Н2).
У стані рівноваги v пр = v зв.
Для даної реакції математичний вираз константи рівноваги має вигляд:
 .
.
Припустимо, що у стані рівноваги концентрація вуглекислого газу СО2
становила х моль/л. Згідно з рівнянням реакції, концентрація водню Н2 буде також х моль/л. На утворення х молів СО2 і х молів Н2 витрачають таку саму кількість молів (на 1 літр) СО і Н2О. Отже, рівноважні концентрації усіх речовин становитимуть [CO2] = [H2] = х моль/л; [CO] = 3 - х моль/л;
[H2O] = 2 - х моль/л.
Тоді

x 2 = 6 - 2 x - 3 x + x 2;
x = 1, 2 (моль/л).
Таким чином, [CO2] = [H2] = 1, 2 моль/л; [CO] = 3 - 1, 2 = 1, 8 моль/л;
[H2O] = 2 - 1, 2 = 0, 8 моль/л.
Задача 8. Запишіть математичний вираз та розрахуйте значення кон-станти рівноваги реакції, поданої рівнянням:
FeO(к) + CO(г)  Fe(к) + CO2(г) ,
Fe(к) + CO2(г) ,
якщо рівноважні молярні концентрації речовин становлять: [CO2] = 0, 05 моль/л; [CO] = 0, 1 моль/л.
Розв’язання. Дана реакція - гетерогенна. Оскільки вона відбувається на поверхні поділу фаз, яка практично не змінюється у процесі, площу поверхні та концентрації твердих речовин можна вважати сталими. Тому у вираз константи рівноваги вводимо тільки рівноважні концентрації газів:
K р =  =
= 
Задача 9. Обчисліть константу рівноваги реакції, поданої рівнянням:
Н2(г) + I2(г)  2НI(г),
2НI(г),
якщо D G 0298(HI) = 1, 3 кДж/моль.
Розв’язання. Для даної реакції константа рівноваги має вигляд:
 .
.
Вільну енергію Гіббса та константу рівноваги процесу зв’язує співвідношення
D G 0х.р = - RT ln K р = -2, 3 RT lg K р,
де D G 0х.р - зміна вільної енергії Гіббса в хімічному процесі за стандартних умов, кДж.
|
|