
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Константа рівноваги
|
|
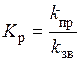 ,
,
де k пр - константа швидкості прямого процесу; k зв - константа швидкості зворотного процесу. Фізичний зміст константи хімічної рівноваги легко зрозуміти. Якщо k пр > k зв, то K р > 1, тобто реакція перебігає необоротно у прямому напрямку до кінця. Якщо k пр < k зв, то K р < 1, тобто реакція проходить необоротно у зворотному напрямку.
Константа рівноваги залежить від природи та агрегатного стану реагуючих речовин, температури і не залежить від концентрацій (або тисків) реагуючих речовин, наявності каталізатора.
Для гетерогенного процесу запис виразу константи рівноваги має певні особливості: він містить тільки концентрації рідких (якщо реакція відбувається у розчині) або газоподібних речовин, якщо реакція відбувається у газовій фазі (або парціальні тиски газів). Концентрації твердих речовин у гетерогенних процесах вважають сталими, а тому не вводять до виразу константи рівноваги процесу.
Хімічна рівновага має динамічний характер і залежить від параметрів стану системи (концентрації, тиску, температури тощо). Зі зміною хоча б одного з параметрів стану системи рівновага в системі порушується, причому в системі відбуватимуться процеси, які сприяють послабленню впливу даного фактора. У такому випадку одна з реакцій (пряма або зворотна) перебігає з більшою швидкістю, поки не встановиться інший стан рівноваги вже за нових рівноважних концентрацій. Цей процес називають зміщенням хімічної рівноваги.
Напрям зміщення стану хімічної рівноваги можна визначити за допомогою принципу Ле Шательє (принципу протидії):
“Зміна будь-якого параметра стану рівноважної системи збільшує швидкість тієї реакції, яка протидіє цій зміні”.
Цей принцип використовують для цілеспрямованого зміщення стану рівноваги у напрямі максимального виходу потрібного продукту реакції, для оптимізації промислових процесів, під час проведення наукових досліджень і вирішення більшості екологічних проблем.
11.3. Запитання для самостійної підготовки
1. Що називають швидкістю хімічної реакції? Як її можна визначити?
2. Які основні фактори та як саме вони впливають на швидкість хімічної реакції (гомогенної, гетерогенної)? Назвіть умови результативних зіткнень.
3. Сформулюйте і запишіть математичний вираз закону діючих мас. Який фізичний зміст константи швидкості хімічної реакції? Від яких факторів вона залежить?
4. Через які стадії проходить гетерогенний процес? У чому полягають
особливості виразу закону діючих мас для гетерогенних реакцій?
Відповідь обґрунтуйте, наведіть приклади.
5. Чому швидкість реакції сильно зростає під час підвищення темпе-ратури? Як можна визначити температурний коефіцієнт швидкості хімічної реакції, який у нього фізичний зміст?
6. У чому суть теорії хімічної взаємодії Арреніуса? Що таке енергія активації ЕА за теорією Арреніуса, від яких факторів вона залежить? Як впливає величина ЕА на швидкість хімічної реакції?
7. Як можна знайти енергію активації реакції? Яке сучасне визначення
енергії активації?
8. Що таке каталіз, каталізатор, інгібітор? Як впливає каталізатор на швидкість хімічної реакції та на зміну енергії активації процесу?
9. Які реакції називають оборотними? Як характеризують стан хімічної рівноваги з погляду термодинаміки, кінетики?
10. Який фізичний зміст константи рівноваги хімічної реакції? Від яких факторів вона залежить? Навести приклади виразів констант рівноваги для гомогенних і гетерогенних процесів.
11. Як зв’язані константа рівноваги процесу і зміна вільної енергії Гіббса?
12. Сформулюйте принцип Ле Шательє. Як можна передбачити вплив температури на зміщення стану хімічної рівноваги? Поясніть на прикладах.
13. Як можна змістити хімічну рівновагу при сталій температурі? Як впливає тиск, концентрації вихідних речовин і продуктів реакції на рівно-важний вихід?
14. Чому введення каталізатора не зміщує стан рівноваги?
|
|