
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Структура и механизм действия пероксидазы хрена
|
|
Пероксидаза — один из наиболее распространенных ферментов, содержащийся в растениях, микробах, тканях животных. Этот фермент катализирует окисление широкого спектра органических соединений пероксидом водорода с образованием токсичных пероксидов, удаляющихся из живых организмов [8]. Пероксидаза представляет собой гликопротеид, состоящий из полипептидной цепи, формирующей двухдоменную глобулу, и гемовой простетической группы с атомом железа, располагающейся между доменами [9].
Основной отличительной особенностью в структуре пероксидазы С хрена по сравнению с другими растительными пероксидазами является наличие участка длиной в 34 аминокислотных остатка между спиралями остатков фенилаланина (F) и глицина G (рис. 1). Эта область, которая является частью канала для доступа субстрата, не встречается у пероксидаз других классов, более того она имеет отличия даже в пределах своего класса. Для пероксидазы С хрена, характеризующейся большей F-G-вставкой (на 7 аминокислотных остатков), идентифицирован ключевой остаток, способный вступать в прямые взаимодействия с ароматическими донорными молекулами. Изофермент С пероксидазы хрена уникален тем, что имеет кольцо из трех периферийных остатков Phe142, Phe68 и Phe179, которое защищает подход к подвергающемуся воздействию краю гема. Эта ароматическая область важна для реализации способности пероксидазы связывать ароматические субстраты.
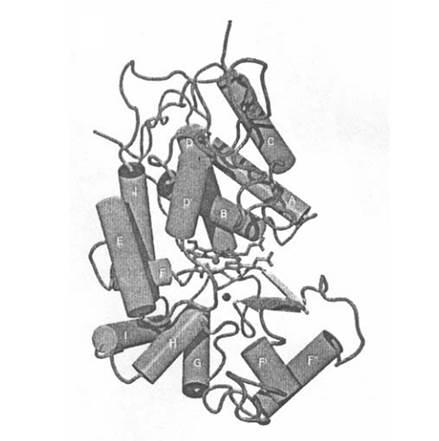
Рис. 1. Пространственная структура пероксидазы C хрена [11].
Особенностью процессов пероксидазного катализа является образование ряда спектрофотометрически различимых комплексов. Упрощенная схема пероксидазного цикла выглядит следующим образом:
Е + H2O2 → E1; k1
E1 + АH2 → E2 + АH; k2
E2 + АH2 → Е + АH; k3
где Е, Е1, Е2 — соответственно исходная пероксидаза и ее окисленные формы; АН2, АН — соответственно исходный субстрат и его окисленная форма.
Продукт первой стадии — E1, образующийся при действии пероксида водорода на фермент, представляет собой окисленное производное пероксидазы, содержащее два окислительных эквивалента. В Е1 железо имеет формальный заряд +4. Дополнительный окислительный эквивалент в молекуле Е1 локализуется либо на порфириновом макроцикле пероксидазы, либо на одной из функциональных групп фермента.
Донорные субстраты могут восстанавливать соединение E1 непосредственно в нативный фермент (двухэлектронное восстановление) или через образование промежуточного соединения E2 (одноэлектронное восстановление).
В реакции пероксидазного окисления, помимо пероксида водорода, в качестве окислителя (первого субстрата) могут выступать органические субстраты – алкилгидропероксиды, пероксибензольные кислоты и др. По отношению ко второму субстрату пероксидаза проявляет меньшую специфичность, поэтому целый ряд электронодонорных соединений могут использоваться в качестве субстратов пероксидазы и являться основой детектирующих систем в методах аналитической биохимии и клинической медицины.
|
|