
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Опыт 4. Автокаталитическая реакция перманганата калия с щавелевой кислотой
|
|
Эта реакция выражается следующим уравнением:
2 KMnO 4 + 5 H 2 C 2 O 4 + 3 H 2 SO 4 = 2 MnSO 4 + K 2 SO 4 + 10 CO 2 + 8 H 2 O
или в ионной форме
2 MnO4 - + 5 H2C2O 4 + 6 H + = 2 Mn 2 + + 10 CO 2 + 8 H 2 O.
Реакция протекает очень медленно. По мере увеличения концентрации ионов Mn 2 + увеличивается скорость их взаимодействия с ионами MnO4 – с образованием Mn 3 +:
MnO4 - + 4 Mn 2 + + 8 H + = 5 Mn 3 + + 4 H 2 O.
Затем ионы Mn 3 + быстро взаимодействуют с щавелевой кислотой:
H2C2O4 + 2 Mn 3 + = 2 Mn 2 + + 2CO 2 + 2 H +.
При этом ион Mn 3 + вновь переходит в ион Mn 2 +, поэтому, если в реакционную смесь сразу добавить ионы Mn 2 +, скорость реакции резко увеличивается. Таким образом реакция перманганата калия с щавелевой кислотой является автокаталитической.
Проведение опыта
1. В каждую из двух пробирок налейте по 1 мл 0, 02 М раствора перманганата калия и 0, 1 М раствора щавелевой кислоты.
2. Прибавьте в каждую пробирку по пять капель 2 М раствора серной кислоты для создания достаточной кислотности.
3. Одну пробирку оставьте для сравнения, а в другую добавьте 3 капли 0, 1 М раствора соли двухвалентного марганца (MnCl 2 или MnSO 4) и включите секундомер.
4. Отметьте время, через которое обесцветились растворы в первой и во второй пробирках.
Обработка результатов
1. Результаты измерений, расчетов и выводы занесите в табл. 4.
2. Отметьте цвета растворов в начале реакции и после ее завершения.
3. Вычислите условную скорость реакции по формуле:
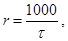
где t - время протекания реакции.
4. Сделайте вывод относительно эффективности действия ионов двухвалентного марганца.
Таблица 4
| Наличие катализатора | Время протекания реакции t, с | Условная скорость реакции r i = 1000 / t i | Наблюдения и выводы |
| отсутствует | |||
| MnCl2 или MnSO 4 |
Контрольные вопросы и задачи для защиты лабораторной работы
Задачи 1 – 4. Энергия активации реакции разложения пероксида водорода в водной среде при температуре 22 0 С равна 75, 6 кДж / моль. При применении данного катализатора энергия активации уменьшается до указанного значения. Оцените, во сколько раз увеличивается константа скорости каталитической реакции при 22 0 С, если предположить, что предэкспоненциальные множители каталитической и некаталитической реакций равны.
| № задачи | Катализатор | Энергия активации, кДж/моль |
| Fe 2 + | ||
| I - | 56, 5 | |
| Pt | ||
| Каталаза (фермент) |
5. Оцените, во сколько раз скорость реакции разложения пероксида водорода, катализируемой ферментом каталаза, больше при 22 0 С чем скорость той же реакции, катализируемой ионами Fe 2 +. Для решения воспользуйтесь данными для задач 1 и 4. Предэкспоненциальные множители реакций равны.
6. Некаталитическое разложение ацетальдегида при 800 К по уравнению:
CH 3 CHO = CH 4 + CO
имеет энергию активации Е 1 = 190, 4 кДж / моль. Применение иода в качестве катализатора уменьшает энергию активации до значения Е 2 = 136, 0 кДж / моль. Оцените температуру, при которой скорость некаталитической реакции станет равна скорости каталитической реакции при температуре Т = 800 К, если предположить, что предэкспоненциальные множители каталитической и некаталитической реакций равны.
7. Реакция разложения ацетальдегида в газовой фазе:
СН3СОН ® СН4 + СО
имеет энергию активации 190 кДж/моль. При температуре 627 0 С под действием паров йода в качестве катализатора константа скорости увеличивается в 10000 раз. Вычислите энергию активации каталитической реакции, предполагая, что предэкспоненциальные множители каталитической и некаталитической реакций равны.
8. Энергия активации реакции 2 SO2 + O2 = 2 SO3 равна Е А = 280 кДж / моль. При применении катализатора (V2O5) энергия активации уменьшается до 92 кДж/моль. Оцените, во сколько раз увеличиваются константы скорости некаталитической реакций и каталитической реакций при повышении температуры от 450 0 С до 500 0 С.
9. Скорость реакции термического распада оксида азота (I) 2 N2O = 2 N2 + O2 резко возрастает в присутствии газообразного брома, который является катализатором. Порядок реакции по N2O равен единице. Установлено, что при увеличении концентрации брома в 2, 2 раза скорость реакции возрастает в 1, 48 раза. Определите порядок реакции по брому и напишите кинетическое уравнение реакции.
10. Предполагают, что реакция разложения муравьиной кислоты (реакция эндотермическая)
НСООН ® СО + Н 2 О
в водном растворе в присутствии ионов водорода протекает по следующему механизму:
1. НСООН + Н + ® (НСООН 2) +,
2. (НСООН 2) + ® (НСО) + + Н 2 О,
3. (НСО) + ® СО + Н +.
Изобразите (качественно) диаграмму потенциальной энергии для данной каталитической реакции.
11. Реакция разложения в газовой фазе A ® B + D катализируется парами вещества К. Известно, что порядок каталитической реакции по веществу А равен 1. Установлено, что при увеличении концентрации К в 2, 8 раза скорость реакции возрастает в 1, 67 раза. Определите порядок реакции по веществу К и напишите кинетическое уравнение реакции.
12. Энергия активации реакции разложения пероксида водорода, катализируемой ионами йода I – равна Е 1 = 56, 5 кДж/моль, а энергия активации той же реакции, катализируемой ионами Fe 2 + равна Е 2 = 42, 0 кДж/моль. Определите, константа скорости какой реакции больше и во сколько раз при 22 0 С. Считать, что предэкспоненциальные множители реакций равны.
13. Реакция 2 Н2 + О2 = 2 Н2О на поверхности твердого катализатора CdO при определенных условиях описывается кинетическим уравнением:
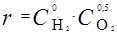 .
.
Как изменится скорость реакции при увеличении общего давления в системе в 2 раза?
| |||||
| |||||
 | |||||
|
 |

|
| ||||||||||||
 | ||||||||||||
| ||||||||||||
 | ||||||||||||
| ||||||||||||
 | ||||||||||||
 |
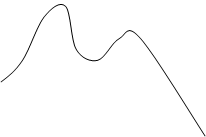
Рис. 1. Энергетическая диаграмма для гомогенной каталитической реакции, протекающей по стадийному механизму: 1 – некаталитическая реакция; 2 – каталитическая реакция.
AВ ¹ - переходное состояние некаталитической реакции;
АК ¹ , AВK ¹ - переходные состояния каталитической реакции;
АК – промежуточное соединение.
|
|