
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторной работы
|
|
1. Что такое катализ? Какие две основные его разновидности известны?
2. Способен ли катализатор вызвать реакцию или он ее только ускоряет?
3. Через какой кинетический параметр влияет катализатор на скорость реакции?
4. Подсчитайте, используя уравнение Аррениуса, во сколько раз увеличивается скорость разложения пероксида водорода при снижении энергии активации реакции с 75, 6 кДж/моль – в отсутствие катализатора, до 54, 6 кДж/моль в присутствии ионов железа (III).
5. Укажите отличительные особенности гомогенного и гетерогенного катализа.
6. Может ли катализатор влиять на состояние химического равновесия в соответствии с принципом Ле Шателье?
Практическая часть
Опыт 1. Сравнение активности различных катализаторов в реакции разложения пероксида водорода
Н2О2 ® Н2О + ½ О2.
В данном опыте сравнивают эффективность действия катализаторов K2Cr2O7 и FeCl3. Скорость реакции обратно пропорциональна времени ее протекания. Последнее определяется как разность между временем окончания и начала выделения пузырьков газа.
1. В две мерные конические пробирки налейте по 1 мл 3 % - го водного раствора пероксида водорода.
2. В одну пробирку добавьте две капли 0, 3 М раствора дихромата калия (K2Cr2O7), а в другую пробирку – четыре капли. С помощью секундомера измерьте время протекания реакции (от начала и до окончания выделения пузырьков газа) в обеих пробирках, а также окраску раствора.
3. Повторяя операции пп. 1-2, проведите аналогичные эксперименты с 0, 3 М раствором FeCl 3 в качестве катализатора.
Обработка результатов
1. Исходные данные, наблюдения, результаты измерений и расчетов, а также выводы занесите в табл. 1.
Таблица 1
| Катализатор | Количество, капли | Время протекания реакции t, с | Условная скорость r i = 1000 / t i | Наблюдения и выводы |
| K2Cr2O7 | ||||
| K2Cr2O7 | ||||
| FeCl 3 | ||||
| FeCl 3 |
2. Отметьте цвета растворов в начале реакции и после ее завершения.
3. Вычислите условную скорость реакции по формуле:
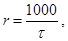
где t - время протекания реакции.
4. Сделайте вывод относительно эффективности действия различных катализаторов.
5. Как влияет на скорость разложения Н2О2 концентрация катализатора?
|
|