
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Скорость реакции в каждый момент времени при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени.
|
|
Если записать уравнение реакции как:
nAA + nBB + nDD ® продукты,
то математическую формулировку основного закона можно представить в следующем виде:
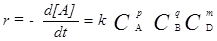 (7)
(7)
где C i - концентрации соответствующих веществ.В этом уравнении коэффициент пропорциональности k называется константой скорости химической реакции. Константы скоростей очень различны для разных реакций и сильно зависят от температуры. Константа скорости химической реакции k численно равна скорости при концентрациях реагирующих веществ равных единице. В учебной и научной литературе основной закон химической кинетики часто называют законом действующих масс.
Показатель степени, в которой концентрация реагента входит в кинетическое уравнение, называется порядком реакции по данному реагенту или частным порядком реакции.
Общий порядок реакции n определяется как алгебраическая сумма показателей степеней при концентрациях всех реагентов, которые входят в кинетическое уравнение:
n = p + q + m.
Частные порядки реакции определяются экспериментально.
Размерность константы скорости химической реакции k определяется общим порядком реакции n = p + q + m и равна (см. уравнение (7)):
[ k ]= [время] - 1 [концентрация] 1 - n.
Вид кинетического уравнения нельзя предсказать исходя из стехиометрического уравнения реакции, он зависит от механизма протекания реакции.
Механизмом реакции называют совокупность элементарных стадий, из которых складывается химическая реакция.
Элементарной называется реакция, которая осуществляется в одну стадию). путем непосредственного превращения реагентов в продукты.
Каждая элементарная реакция (стадия) представляет собой совокупность большого числа однотипных превращений исходных частиц - элементарных актов химического превращения.
|
|