
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическая часть. Гомогенныминазываются реакции, протекающие в одной фазе (в смеси газов, в жидком растворе или в твердой фазе).
|
|
Гомогенными называются реакции, протекающие в одной фазе (в смеси газов, в жидком растворе или в твердой фазе).
Важнейшей количественной кинетической характеристикой любой химической реакции является ее скорость. Наиболее общим является определение скорости реакции r как скорости возрастания степени завершенности реакции x (греческая буква " кси"), которую называют химической переменной. Пусть в закрытой системе протекает химическая реакция
n1A1 + n2A2 = n3A3 + n4A4 (1)
где A1, A2,..., Ai - участники реакции; n1, n2,..., ni - стехиометрические коэффициенты. Тогда химическая переменная xi, характеризующая глубину протекания реакции по i-ому компоненту, определяется как
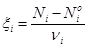 (2)
(2)
где Ni - число молей i-го компонента в момент времени t, Ni0 - число молей того же компонента в начальный момент времени (t = 0), ni - стехиометрический коэффициент при i- ом компоненте в уравнении реакции. Стехиометрические коэффициенты у исходных веществ берутся со знаком минус, а у продуктов реакции - со знаком плюс. При таком выборе знаков глубина протекания реакции всегда положительна независимо от участника реакции.
Скорость гомогенной химической реакции r определяется как скорость изменения глубины протекания реакции в единицу времени в единице объема:
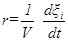 (3)
(3)
где V - объем системы. Определенная таким образом скорость реакции не зависит от выбора компонента и будет практически одинаковой для разных веществ, участвующих в реакции. Дифференциальная форма уравнения (2) имеет вид
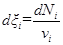 .
.
С его учетом из уравнения (3) для r, получаем
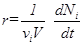 .
.
Величина
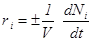 (4)
(4)
называется скоростью реакции по i- ому компоненту. Она характеризует изменение количества i - ого вещества Ni (в молях) в единицу времени в единице объема. Таким образом, скорость реакции в целом и скорости реакции по отдельным компонентам связаны следующим соотношением
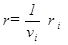 . (5)
. (5)
Выражения (3) и (4) является строгими определениями скоростей реакций, справедливыми и для системы переменного объема.На практике часто пользуются более простым уравнением, пригодным для реакции в системе постоянного объема. Так как отношение Ni / V равно концентрации вещества C i, то при постоянном объеме
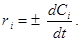 (6)
(6)
Скорость реакции (при постоянном объеме) представляет собой изменение концентрации данного вещества в единицу времени.
Скорость реакции всегда положительная величина. В выражении (6) используют знак плюс, если скорость определяется по образующемуся в реакции веществу (продукту), и знак минус, если скорость определяется по расходующемуся в реакции веществу (реагенту). Этим учитываются разные знаки стехиометрических коэффициентов реагентов и продуктов реакции.
Уравнение (6) наиболее часто применяют для реакций в растворах и для реакций газов в замкнутых реакционных сосудах. Если концентрация измеряется в моль/л, а время в секундах, то скорость реакции имеет размерность моль/(л× с).
Кинетический эксперимент заключается в том, что при проведении реакции по мере ее протекания анализируют тем или иным экспериментальным методом концентрации исходных веществ и продуктов реакции. Результаты такого эксперимента представляют в виде кинетических кривых образования и расходования соответствующих веществ. Под кинетической кривой понимают график зависимости концентрации реагента или продукта реакции от времени.
|
|