
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Опыт следует проводить в вытяжном шкафу. Работают параллельно с двумя веществами.
|
|
В две пробирки помещают по 1 мл конц. азотной кислоты, добавляют в них соответственно 5-6 капель одного из углеводородов и сильно встряхивают. Жидкости в пробирках образуют нестойкую, быстро расслаивающую эмульсию. Продолжая часто встряхивать, нагревают смеси почти до кипения. Отмечают различие хода процесса в разных пробирках.
После 1-2 мин нагревания со встряхиванием пробирки приливают в каждую по 4-5 мл холодной воды. Отмечают характерный запах продуктов реакции. В двух пробирках продукты реакции выделяются в виде тяжелого окрашенного масла.
Лабораторная Работа №
СПИРТЫ
Опыт 1. Растворимость спиртов в воде, горение спиртов
Реактивы и оборудование: спирты (этиловый, пропиловый, бутиловый, амиловый или изоамиловый); фарфоровые чашки, лучинки, пробирки.
А. В четыре пробирки наливают по 2 мл воды и в каждую добавляют по 0, 5 мл этилового, пропилового, бутилового, амилового (или изоамилового) спиртов соответственно. Пробирки хорошо встряхивают. Отмечают, что этиловый и пропиловый спирты прекрасно растворяются в воде, бутиловый спирт растворяется плохо, а при растворении амилового спирта образуется эмульсия, которая быстро расслаивается. При этом амиловый (изоамиловый) спирт, подобно маслу, всплывает на поверхность воды. Отсюда и возникло название «сивушное масло», под которым понимают смесь высокомолекулярных одноатомных спиртов, в том числе и изоамилового. Высшие спирты могут образовываться при спиртовом брожении, поэтому при разбавлении водой плохо очищенного от сивушного масла этилового спирта происходит помутнение раствора.
Объясните, почему выше перечаленные спирты по-разному растворяются в воде.
Б. В три фарфоровые чашки наливают по 1 мл этилового, бутилового и амилового спиртов. Спирты поджигают лучиной и наблюдают характер горения. Высокомолекулярные спирты горят более коптящим и ярким пламенем.
Напишите уравнения реакций горения указанных спиртов и рассчитайте в них содержание углерода (в масс. %).
Опыт 2. Обнаружение воды в спирте и обезвоживание спирта
Реактивы и оборудование: этиловый спирт (ректификат), сульфат меди CuSO4× 5Н2О (в порошке); пробирки, пипетки.
В фарфоровой чашке или тигле нагревают на пламени горелки 1, 5–2 г CuSO4× 5Н2О, перемешивая соль медной проволочкой, до полного исчезновения голубой окраски соли и прекращения выделения паров воды. Дают остыть полученному белому порошку, пересыпают его в сухую пробирку и добавляют 2–3 мл этилового спирта. При встряхивании и слабом нагревании содержимого пробирки белый порошок быстро окрашивается в голубой цвет.
Опыт 3. Образование и гидролиз алкоголята
Реактивы и оборудование: этиловый спирт (обезвоженный, из опыта 1), натрий металлический; пробирки, скальпель, пинцет, фильтровальная бумага, проволока, лучины.
Полученный в опыте 1 обезвоженный этиловый спирт осторожно сливают с осадка в сухую пробирку и погружают в него кусочек чистого (свежеотрезанного, очищенного и отжатого от керосина) металлического натрия размером с горошину. Охлаждая пробирку в стакане с водой, предотвращают разогревание смеси и выкипание спирта. Когда газ станет выделяться спокойно, подносят к отверстию пробирки горящую лучину. Выделяющийся водород образует с воздухом смесь, вспыхивающую с характерным резким звуком.
Жидкость постепенно густеет, натрий покрывается слоем твердого алкоголята, и реакция замедляется настолько, что для её ускорения требуется слегка нагревать пробирку. Если выделение водорода почти прекратится, а натрий полностью не растворится, подогревают смесь до разжижения, удаляют из него оставшийся кусочек натрия при помощи изогнутой проволочки и помещают его в банку для остатков натрия.
2ROH + 2Na ® 2RONa + H2
Полученный концентрированный раствор алкоголята при охлаждении закристаллизовывается.
Добавляют в ту же пробирку 5–6 мл воды и испытывают фенолфталеином реакцию полученного раствора.
RONa + H2O ® ROH + NaOH
Опыт 4. Качественные реакции на спирты
Реактивы и оборудование: спирты (этиловый, изопропиловый, третичный бутиловый, бензиловый, аллиловый), реактив Лукаса (16 г безводного хлорида цинка в 10 мл концентрированной соляной кислоты), реактив Дениже (5 г оксида ртути (II) в 100 мл воды и 20 мл концентрированной серной кислоты); стаканы на 100/150 мл, пипетки, пробирки.
А. Проба Лукаса (обнаружение первичного, вторичного и третичного спиртов). В сухой пробирке к 0, 5 мл реактива Лукаса прибавьте 3–4 капли исследуемого спирта, энергично встряхните и оставьте в стакане с водой при 30°С на 1–2 мин. В пробирке с первичным спиртом раствор остаётся прозрачным, в пробирке с вторичным спиртом происходит помутнение жидкости, а если спирт третичный — на дне образуется масляный слой алкилгалогенида (различная подвижность гидроксигруппы в спиртах). Сделайте выводы.
Примечание. Различить третичные и вторичные спирты можно пробой с концентрированной соляной кислотой без хлорида цинка. В этих условиях третичные спирты реагируют в течение 3–5 минут, вторичные не реагируют.
Б. Проба Дениже (обнаружение третичных спиртов). 3 мл реактива Дениже кипятят в течение 1–3 мин. с 1 мл исследуемого вещества. Третичные спирты образуют осадок жёлтого или красного цвета, в то время как первичные или вторичные спирты если и образуют осадок, то белого цвета.
Опыт 5. Окисление этилового спирта
Реактивы и оборудование: этиловый спирт, бихромат калия (5%-ный водный раствор), перманганат калия (2н водный раствор), разбавленная и концентрированная серная кислота; пробирки.
А. Окисление хромовой смесью. Смешивают в пробирке 2 мл раствора бихромата калия, 1 мл разбавленной серной кислоты и 0, 5 мл этилового спирта и осторожно нагревают смесь. Течение реакции окисления обнаруживается по изменению окраски раствора, а образование ацетальдегида — по его характерному запаху.
В. Окисление перманганатом калия. Поместите в пробирку 2 капли этилового спирта, 2 капли раствора перманганата калия и 3 капли концентрированной серной кислоты. Слегка нагрейте пробирку слабым пламенем горелки. Начинается обесцвечивание розового раствора, и выпадают бурые хлопья оксида марганца (IV). При избытке серной кислоты образуется бесцветный раствор. Ощущается запах уксусного альдегида. Напишите уравнение реакции.
Опыт 6. Комплексообразование многоатомных спиртов
Реактивы и оборудование: глицерин, этиловый спирт, этиленгликоль, сульфат меди (3%-ный водный раствор), гидроксид натрия (2н водный раствор), соляная кислота (разбавленная 1: 5); пипетки, пробирки.
Поместите в пробирку 3 капли раствора сульфата меди, 3 капли раствора щёлочи и взболтайте. Появляется голубой студенистый осадок гидроксида меда (II), который при нагревании до кипения разлагается, выделяя черный осадок оксида меди (II).
Повторите опыт, но перед кипячением гидроксида меди (П) добавьте в пробирку 2–3 капли многоатомного спирта. При взбалтывании осадок растворяется и появляется тёмно-синее окрашивание образовавшегося глицерата меди.
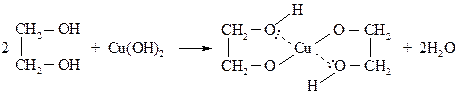
При кипячении глицерат меди не разлагается и окраска не изменяется. Гликоляты устойчивы в щелочной среде, но разлагаются на исходные соединения (соли меди и гликоли) в кислой среде.
Лабораторная РАБОТА №
|
|