
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Для выполнения контрольной работы
|
|
Основной
1. Кругляков П.М. Физическая и коллоидная химия: Учеб. пособие/ П.М. Кругляков, Т.Н. Хаскова. – 2-е изд., испр. – М.: Высш. шк., 2007. – 319 с.
Дополнительный
1. Маринкина Г.А. Физическая и коллоидная химия: практикум/ Г.А. Маринкина, Н.П. Полякова, Ю.И. Коваль; Новосиб. гос. аграр. ун-т. - Новосибирск: НГАУ, 2009. – 151 с.
2. Сумм Б.Д. Основы коллоидной химии: учеб. пособие для вузов/ Б.Д. Сумм. – 2-е изд., стер. – М.: ACADEMIA, 2007. – 240 с.
Основная и дополнительная литература, рекомендованная рабочей программой, имеется в библиотеке НГАУ.
Интернет-ресурсы: www.xumuk.ru, www.chem.msu.ru, www.himhelp.ru.
КОНОТРОЛЬНАЯ РАБОТА
Вариант 1
1. Вычислите, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если получено 336, 1 г железа.
2. Вычислите Δ Sº и Δ Gº следующих реакций и определите возможность их осуществления в стандартных условиях:
а) 2КСlО3(к) = 2КСlО(к) + 2О2(г);
б) Са(ОН)2(к) + СО2(г) = СаСО3(к) + Н2О(ж).
3. Кажущаяся степень диссоциации сернокислого цинка в 0, 1 н растворе равна 40%. Определите осмотическое давление раствора при 0оС.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных цинкового и серебряного электродов, j Zn2+/Zn = − 0, 763 В; j Ag+/Ag = 0, 799В. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Вычислите электродный потенциал меди, погруженной в раствор CuSO4 с концентрацией CuSO4 = 0, 02 М; j Cu+2/Cu = 0, 34 В.
6. Составьте схемы электролиза водных растворов солей Na2CO3 и FeCl2.
7. Сколько кулонов электричества надо пропустить через раствор соли AgNO3, чтобы выделить 1, 7 г серебра? Какой объем газа при этом выделится на аноде?
8. Подберите анодное и катодное покрытие для никеля. Опишите коррозийный процесс при нарушении катодного покрытия.
9. Свинцовый кабель, лежащий в земле, подвергается коррозии блуждающим током силой 50 А. Кабель выйдет из строя, когда растворится 2, 5 кг свинца. Сколько времени может работать кабель?
10. Даны металлы: магний-никель. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 3 и 10.
11. Уравнение адсорбции Гиббса, его анализ.
12. Молекулярно-адсорбционная хроматография.
13. Определите рН 0, 01 н раствора NН4ОН, если КNН 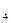 ОН = 1, 86·10-5.
ОН = 1, 86·10-5.
14. Опишите дисперсную систему: эмульсия. Приведите примеры эмульсий.
15. Напишите формулу мицеллы, полученной при взаимодействии сульфата меди с избытком гидроксида калия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 2
1. При растворении 16 г СаС2 в воде выделяется 31, 5 кДж теплоты. Определите стандартную энтальпию образования Са(ОН)2.
2. Определите возможность получения метана по реакции: СО(г) + 3Н2(г) = СН4(г) + Н2О(г) при 40°С.
3. Одинаково ли осмотическое давление 1 М растворов следующих веществ: глюкозы С6Н12О6, уксусной кислоты СН3СООН и азотной кислоты НNО3? Ответ мотивируйте.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных цинкового и медного электродов, j Zn2+/Zn = − 0, 763 В; j Cu2+/Cu = 0, 34 В. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Составьте схему гальванического элемента, при работе которого протекает реакция:
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
Напишите уравнения реакций, протекающих на электродах, рассчитайте ЭДС, если С (Ni2+) = 0, 01моль/л;
С(Pb2+) = 0, 01 моль/л; j(Ni2+/Ni) = − 0, 23 B; j(Pb2+/Pb) = − 0, 13 В.
6. Составьте схемы электролиза водных растворов солей KJ и CuSO4
7. При электролизе раствора соли ZnSO4 за 14 мин на катоде выделилось 1, 72г цинка. Какова была сила тока? Какой газ и в каком объеме выделился при этом на аноде?
8. Сплав серебра и меди покрыт слоем золота. Составьте схемы процессов коррозии, идущих при нарушении целостности покрытия. Какие процессы будут идти, если сплав защитить цинковым протектором?
9. Медная шина защищена цинковым протектором. Сколько времени будет работать протектор массой 15 кг, если сила коррозийного тока составляет 0, 04 А? Привести схему процессов коррозии.
10. Даны металлы: магний-медь. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 2 и 12.
11. Изотерма адсорбции, типы изотерм адсорбции.
12. Распределительная хроматография.
13. Вычислите рН 3, 12%-го раствора НСl (ρ =1, 015 г/мл).
14. Опишите дисперсную систему: суспензия. Приведите примеры суспензий.
15. Напишите формулу мицеллы, полученной при взаимодействии сульфида натрия с избытком хлорида кадмия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 3
1. Вычислите тепловые эффекты реакций сгорания 10 г следующих веществ: С (графит), Н2(г), Р(к), Мg(к), Н2S(г), С2Н5ОН(ж), С6Н12О6(к).
2. Определите, при какой температуре начнется реакция восстановления Fe2O3 оксидом углерода:
Fe2O3(к) + СО(г) = 2FeO(к) + СО2(г);
Δ Hº r = 64, 75 кДж.
3. Вычислите величину осмотического давления следующих растворов при 0оС: а) 0, 1 н раствора гидроксида калия (α =89%), б) 0, 1 н раствора сульфата натрия (α =69%).
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных никелевого и серебряного электродов, j Ni2+/Ni = − 0, 23 В; j Ag+/Ag = 0, 799В. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Электродвижущая сила Cu – Zn гальванического элемента равна 1, 04 В. Рассчитайте концентрацию ионов меди в медном электролите j Cu2+/Cu = 0, 34В; j Zn2+/Zn = − 0, 763 В. Концентрация цинкового электролита 0, 1 моль/л.
6.Составьте схемы электролиза водных растворов солей Pb(NO3)2 и КС1.
7. Чему равна атомная масса четырехвалентного металла, если за 10 мин из раствора соли ток силой 5 А выделил 1, 517 г этого металла? Что это за металл? Назовите его.
8. Никелевая пластинка покрыта слоем свинца. Как будет идти процесс коррозии при нарушении покрытия? Приведите схему процесса.
9. Оцинкованное железо при нарушении цинкового покрытия начинает разрушаться само после растворения 40% площади покрытия. Сколько времени будет осуществляться защитное действие цинкового покрытия, если исходная масса покрытия 400 г, а сила коррозийного тока 0, 02 А?
10. Даны металлы: алюминий-серебро. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 8 и 3.
11. Поверхностно-активные вещества, особенности строения молекул.
12. Ионообменная хроматография.
13. Определите рН раствора, в 1 л которого содержится 0, 1 г NаОН.
14. Опишите дисперсную систему: пена. Приведите примеры.
15. Напишите формулу мицеллы, полученной при взаимодействии сульфата натрия с избытком хлорида бария. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 4
1. Определите стандартную энтальпию образования сероуглерода CS2, если известно, что
CS2(ж) + 3О2(г) = СО2(г) + 2SO2(г) – 1075 кДж.
2. Определите, какой из карбонатов, СаСО3 или ВаСО3, можно получить по реакции взаимодействия соответствующего оксида с углекислым газом в стандартных условиях.
3. Кажущаяся степень диссоциации раствора азотной кислоты, содержащего 31, 5 г НNO3 в 500 г воды, равна 80%. Рассчитайте температуру замерзания этого раствора.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных свинцового и ртутного электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Вычислите ЭДС гальванического элемента, состоящего из стандартного водородного и медного электродов, если С(CuSO4)=0, 001М. Напишите уравнения реакций, протекающих на электродах.
6. Составьте схемы электролиза водных растворов солей MgSO4 и CuCl2.
7. При электролизе водного раствора соли Cr2(SO4)3 током силой 2 А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз? Какой продукт и в каком количестве выделился при этом на аноде?
8. Приведите по одному примеру катодного и анодного покрытия свинца и опишите схемы процессов коррозии при нарушении каждого из покрытий на свинце.
9. В качестве протектора для защиты медной шины использована железная болванка массой 25 кг. сколько времени будет работать протектор если сила коррозийного тока составит 0, 03 А? Составьте схему процесса коррозии.
10. Даны металлы: алюминий-никель. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 9 и 2.
11. Примеры применения поверхностно-активных веществ.
12. Осадочная хроматография.
13. К 1 л воды добавили 2 мл 72%-го раствора НNО3 (ρ =1, 48 г/мл). Раствор разбавили водой до 2 л. Вычислите рН полученного раствора.
14. назовите основные особенности гелей. Приведите примеры гелей.
15. Напишите формулу мицеллы, полученной при взаимодействии хлорида бария с избытком серной кислоты. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 5
1. Вычислите, сколько теплоты выделится при сгорании 4, 48 л этилена в стандартных условиях.
2. Определите, при какой температуре, 500 К или 2000 К, будет самопроизвольно протекать реакция: Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г).
3. Рассчитайте величину осмотического давления раствора, содержащего в 1 л 3, 1 г анилина (С6Н5NН2). Температура раствора 21оС.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных магниевого и никелевого электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Рассчитайте ЭДС гальванического элемента, составленного из цинкового и Fe и Pb электродов, концентрации С(Fe2+) = C (Pb2+) = 0, 1 М. Напишите уравнения процессов, протекающих на электродах j Fe3+/Fe = − 0, 44 B; j Pb2+/Pb = − 0, 13 B.
6. Составьте схемы электролиза водных растворов солей SnBr2 и Al(NO3)3.
7. Чему равен эквивалент кадмия, если для выделения 1 г его из раствора соли надо пропустить через этот раствор 1717 кл электричества?
8. Цинковое изделие содержит примеси алюминия и олова. Какая из этих примесей «вреднее» с точки зрения коррозии цинкового изделия? Опишите возможные процессы в этом изделии.
9. Трамвайный рельс подвергается коррозии блуждающим током силой 22 А. Через какой отрезок времени придется сменить рельс, если потеря массы железа при этом составить 12 кг?
10. Даны металлы: алюминий-кадмий. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 5 и 11.
11. Поверхностно неактивные вещества, особенности строения молекул.
12. Классификация хроматографических методов анализа.
13. Вычислите рН 0, 01 М раствора муравьиной кислоты. КНСООН=1, 8·10-4.
14. Опишите дисперсную систему: туман. Приведите примеры аналогичных дисперсных систем.
15. Напишите формулу мицеллы, полученной при взаимодействии хлорида цинка с избытком гидроксида натрия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 6
1. Тепловой эффект реакции
3N2O(г) + 2NH3(г) = 4N2(г) + 3Н2O(г) равен 878, 64 кДж. Вычислите Δ Hº f(N2O).
2. Определите, при какой температуре наступит равновесие в системе: Н2(г) + СО2(г) = СО(г) + Н2О(пар); Δ Hº r = -2, 85 кДж.
3. Осмотическое давление водного раствора, содержащего в 100 мл 1 г сахарозы С12Н22О11, равно 0, 655 атм при 0оС. Рассчитайте величину универсальной газовой постоянной R.
4. Составьте схемы двух гальванических элементов, в одном из которых кадмий является анодом, а в другом – катодом. Напишите уравнения реакций, протекающих на электродах
5. Гальванический элемент состоит из металлического цинка, погруженного в 0, 1М раствор нитрата цинка и металлического свинца, погруженного в 0, 02М раствор нитрата свинца. Вычислить ЭДС элемента, написать уравнения электродных процессов, составить схему гальванического элемента.
6. Составьте схемы электролиза водных растворов солей AlCl3 и Hg(NO3)2.
7. Какое количество электричества потребуется для выделения из раствора 2 г водорода?
8. Контакт меди со свинцом находится в растворе HCl. Как будет идти процесс коррозии и на каком из металлов будет выделяться водород?
9. За сколько времени полностью разрушится за счет коррозии выброшенная консервная банка (Fe-Sn), если масса железа составляет 45 г (массой олова пренебречь), а сила коррозийного тока будет 0, 01 А?
10. Даны металлы: алюминий-цинк. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 7 и 2.
11. Изотерма адсорбции Фрейндлиха. Области применения адсорбции.
12. Напишите реакции взаимодействия гексин-1 с Н2, Н2О. Назовите полученные соединения.
13. К 200 мл 10%-го раствора NаОН (ρ =1, 12 г/мл) добавили 200 мл воды. Вычислите рН и рОН раствора.
14. Опишите дисперсную систему: аэрозоль. Приведите примеры аналогичных дисперсных систем.
15. Напишите формулу мицеллы, полученной при взаимодействии бромида калия с избытком нитрата серебра. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 7
1. При сгорании 23 г этилового спирта выделилось 622, 6 кДж теплоты. Вычислите стандартную энтальпию образования С2Н5ОН.
2. Сделайте вывод о возможности протекания реакции в стандартных условиях: СН4(г) + СО2(г) = 2СО(г) + 2Н2(г).
3. Раствор, содержащий в 1 л 3, 75 г формалина, обладает осмотическим давлением 2, 8 атм. при 0оС. Определите молярную массу формалина.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных хромового и вольфрамового электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Напишите уравнения реакций, протекающих при работе гальванического элемента:
Pb|Pb(NO3)2 0, 0001М || Pb(NO3)2 1М | Pb
Рассчитайте ЭДС, если j0 Pb2+/Pb = –0, 13 В.
6. Составьте схемы электролиза водных растворов солей K3PO4 и HgCl2 .
7. Вычислите массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор соли AgNO3 в течение 30 мин. Какой продукт и в каком количестве выделится при этом на аноде?
8. Протектором из какого металла можно защитить железо-никелевый сплав? Опишите процессы коррозии в отсутствии и в присутствии протектора.
9. Сколько времени будет работать цинковое покрытие на оцинкованном листе кровельного железа, если защищающая масса цинка 0, 4 кг, а сила коррозийного тока 0, 015А?
10. Даны металлы: золото-никель. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 10 и 1.
11. Графическое изображение изотермы адсорбции Фрейндлиха и определение ее констант.
12. Газовая хроматография.
13. Вычислите рН раствора уксусной кислоты, в 400 мл которого содержится 45 г СН3СООН, КД(СН3СООН) = 1, 86·10-5.
14. Опишите дисперсную систему: эмульсия. Приведите примеры эмульсий.
15. Напишите формулу мицеллы, полученной при взаимодействии нитрата железа (II) с избытком сульфата калия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 8
1. Вычислите, сколько теплоты выделится при сгорании 4, 48 л этилена в стандартных условиях.
2. Определите Δ Gº реакции, протекающей по уравнению: 4NН3(г) + 5О2(г) = 4NО(г) + 6Н2О(г). Сделайте вывод о возможности протекания ее в стандартных условиях.
3. Осмотическое давление водного раствора, содержащего 3 г в 250 мл раствора, равно 0, 82 атм при 12оС. Определите молярную массу вещества.
4. Составьте схемы двух гальванических элементов, в одном из которых цинк является анодом, а в другом катодом.
5. Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO3, и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его ЭДС?
6. Составьте схемы электролиза водных растворов солей ZnSO4 и CaBr2 .
7. При прохождении через раствор соли трехвалентного металла тока силой 1, 5 А в течение 30 мин на катоде выделилось 1, 071 г металла. Вычислить атомную массу металла и назвать его.
8. Сплав олова с цинком опущен в раствор серной кислоты. На каком металле будет выделяться водород? Составьте схему гальванического элемента работающего при коррозии сплавов.
9. В сплаве Zn-Sn-Cu-Pb олово, в основном, сосредоточено в межкресталитном слое. Через какой отрезок времени сплав перестанет работать как конструкционный материал, если масса олова составляет 1, 2% сплава (вес конструкции 1, 40 т), а сила коррозийного тока 0.04А? Приведите схемы возможных в сплаве процессов коррозии.
10. Даны металлы: титан-никель. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 12 и 2.
11. Особенность поведения веществ на границе раздела фаз.
12. Жидкостная хроматография.
13. Вычислите рН 0, 6%-го раствора NаОН (ρ =1, 069 г/мл).
14. Опишите дисперсную систему: дым. Приведите примеры аналогичных дисперсных систем.
15. Напишите формулу мицеллы, полученной при взаимодействии сульфата кадмия с избытком сероводородной кислоты. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 9
1. При взаимодействии газообразных сероводорода и оксида углерода (IV) образуются пары воды и сероуглерода CS2(г). Напишите термохимическое уравнение этой реакции, вычислите ее тепловой эффект в стандартных условиях.
2. Эндотермическая реакция протекает по уравнению:
СН4(г) + СО2(г) = 2СО(г) + 2Н2(г); Δ Hº r = 247, 37 кДж
Рассчитайте, при какой температуре начнется эта реакция.
3. Сколько граммов глюкозы С6Н12О6 должен содержать 1 л раствора, чтобы его осмотическое давление было таким же, как у раствора, содержащего в 1 л при этой же температуре 3 г формалина (НСНО)?
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных железного и ртутного электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Составьте уравнения процессов, протекающих на электродах цинк-кадмиевого гальванического элемента в котором С (Zn2+) = C (Cd2+) = 0, 01 М; j0 Zn2+/Zn = -0, 763 В; j0 Cd2+/Cd = -0, 13 В.
6. Составьте схемы электролиза водных растворов солей MnCl2 и Cu(NO3)2
7. При электролизе раствора соли ZnSO4 за 27 мин на катоде выделилось 3, 25 г цинка. Какова была сила тока? Какой газ и в каком объеме выделился при этом на аноде?
8. Никелевая пластинка покрыта сначала тонким слоем цинка, а поверх цинка – тонким слоем марганца. Составьте схемы коррозии:
а) при нарушении слоя марганца;
б) при нарушении второго защитного слоя, цинкового.
9. Сплав Cu-Pb подвергается коррозии блуждающим током силой 120 А. за сколько времени полностью растворится 18 кг этого сплава (содержит 15% Pb).
10. Даны металлы: титан-медь. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 10 и 3.
11. Адсорбция. Виды адсорбции. Факторы, влияющие на процессы адсорбции.
12. Колоночная хроматография.
13. Вычислить рН раствора соляной кислоты, в 200 мл которого содержится 0, 365 г НСl.
14. К какому типу дисперсных систем относятся облака. Приведите примеры аналогичных дисперсных систем.
15. Напишите формулу мицеллы, полученной при взаимодействии нитрата бария с избытком сульфата цинка. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 10
1. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
FeO(к) + СО(г) = Fe(к) + СO2(г) + 13, 18 кДж;
СО(г) + 1/2О2(г) = СО2(г) + 283, 0 кДж;
Н2(г) + СО2(г) = Н2О(г) + 241, 83 кДж.
2. Рассчитайте, при какой температуре наступит равновесие системы: СО(г) + 2Н2(г) = СН3ОН(ж); Δ Hº r = -128, 05 кДж.
3. Вычислите осмотическое давление 5%-го раствора ацетона в воде при 0оС. Плотность раствора 0, 90 г/мл.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных кадмиевого и ртутного электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Определите, что является восстановителем, а что окислителем в гальваническом элементе, состоящем из Cu-Ag электродов. Составьте схему гальванического элемента, уравнения процессов, протекающих на электродах. Рассчитайте ЭДС, если С (Cu2+) = C (Ag+) = 1М.
6. Составьте схемы электролиза водных растворов солей: AlI3 и CaBr2.
7. Вычислите, сколько времени (в мин.) потребуется для получения 3 г золота при электролизе водного раствора AuCl3 силой тока 4 А.
8. Пластины из меди и никеля соединены алюминиевыми заклепками. Опишите процессы коррозии, идущие: а) на границе медь-никель; б) на контактах медь – алюминий; в) никель – алюминий.
9. Электрический медный контакт посеребрен. Какой процесс пойдет при нарушении покрытия? За какое время полностью разрушится серебряное покрытие массой 0, 6 кг, если блуждающие токи при включении – выключении составляют 40 А, продолжительность каждой операции 0, 2 с, а регулярность включения – выключения 2 раза в минуту?
10. Даны металлы: серебро-никель. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 7 и 2.
11. Понятие об ионообменной адсорбции.
12. Капиллярная хроматография.
13. Вычислите рН раствора йодноватой кислоты c концентрацией 0, 1 М. КД(НIO3) = 1, 6·10-2.
14. Опишите дисперсную систему: суспензия. Приведите примеры суспензий.
15. Напишите формулу мицеллы, полученной при взаимодействии хлорида натрия с избытком нитрата серебра. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 11
1. При взаимодействии 3 молей оксида азота (I) N2O с аммиаком образуются азот и пары воды. Тепловой эффект реакции равен –877, 76 кДж. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования N2O(г).
2. Укажите, какая из двух реакций:
а) 2Fe(к) + Аl2O3(к) = Fe2O3(к) + 2Al(к);
б) Fe3O4(к) + СО(г) = 3FeO(к) + СО2(г)
будет протекать самопроизвольно в стандартных условиях.
3. Рассчитайте изотонический коэффициент для раствора хлорида магния, содержащего 0, 1 моль МgCl2 в 1 кг воды, если температура замерзания раствора -0, 461оС.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных кадмиевого и свинцового электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg2+ 0, 1 и 0, 01 моль/л.
6. Составьте схемы электролиза водных растворов солей NiSO4 и MgBr2 .
7. Какие окислительно-восстановительные процессы протекают у электродов при электролизе соли CuCl2? Какие вещества и в каком количестве выделяются у электродов при прохождении через раствор тока силой 4 А в течение 40 мин?
8. Какая из примесей более опасна для железа как конструктивного материала – медь или магний? Опишите коррозийные процессы, идущие в том и в другом случаях.
9. В качестве протектора для защиты от коррозии сплава Cu-Ni используется цинк. Опишите процессы, за счет которых идет разрушение цинка. За какое время разрушится протектор массой 10 кг, если сила коррозийного тока 0, 05 А?
10. Даны металлы: железо-индий. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 4 и 10.
11. Адсорбционная способность почв, ее значение.
12. Тонкослойная хроматография.
13. Вычислите рН раствора бромноватистой кислоты с концентрацией 0, 001 н. КД(НВrO) = 2, 2·10-9.
14. Какие виды устойчивости дисперсных систем вы знаете? Поясните на примере.
15. Напишите формулу мицеллы, полученной при взаимодействии нитрата меди (II) с избытком фосфата натрия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 12
1. При сгорании газообразного аммиака образуются пары воды и оксид азота (II) NO(г). Вычислите тепловой эффект реакции в расчете на 1 моль NН3(г). Напишите термохимическое уравнение этой реакции.
2. Вычислите Δ Sº и Δ Gº следующих реакций и определите возможность их осуществления в стандартных условиях:
а) 2КСlО3(к) = 2КСlО(к) + 2О2(г);
б) Са(ОН)2(к) + СО2(г) = СаСО3(к) + Н2О(ж).
3. Температура кипения раствора, содержащего 9, 09 г нитрата калия в 100 г воды, равна 100, 8оС. Вычислите степень диссоциации КNO3 в этом растворе.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных цинкового и оловянного электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. ЭДС элемента, состоящего из медного и свинцового электродов, погруженных в 1 М растворы солей этих металлов, равна 0, 47 В. Изменится ли ЭДС, если взять 0, 001 М растворы? Ответ обосновать.
6. Составьте схемы электролиза водных растворов солей FeCl2 и Hg(NO3)2.
7. Определите, чему равен эквивалент висмута, если для выделения 10 г его из раствора соли надо пропустить через этот раствор 13850 Кл электричества.
8. Опишите схемы коррозийных процессов, идущих в месте соединения металлических листов железа, никеля и меди, соединенных алюминиевой заклепкой.
9. Кабель связи защищен свинцовым экраном, который подвергается коррозии блуждающим током силой 50 А. Сколько времени будет работать экран, если он выйдет из строя после растворения 12 кг свинца
10. Даны металлы: свинец-медь. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 3 и 12.
11. Значение сорбционных процессов в биологических системах.
12. Бумажная хроматография.
13. К 20 мл 0, 01 н раствора NаОН прибавили 40 мл 0, 01 н раствора НСl. Вычислите рН полученного раствора.
14. Назовите основные особенности золей. Приведите примеры золей.
15. Напишите формулу мицеллы, полученной при взаимодействии хлорида кальция с избытком карбоната натрия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 13
1. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен 3135 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования бензола Δ Hº f.
2. Вычислите изменение энтропии для реакций, которые могут быть описаны уравнениями:
2СН4(г) = С2Н2(г) + 3Н2(г);
С(графит) + О2(г) = СО2(г);
N2(г) + 3Н2(г) = 2NН3(г).
Объясните величину и знак Δ Sº.
3. Раствор, содержащий 0, 53 г карбоната натрия в 200 г воды, замерзает при -0, 13оС. Вычислите степень диссоциации Nа2СО3 в этом растворе.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных магниевого и марганцевого электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Определите восстановитель и окислитель в гальваническом элементе, составленном из хрома, погруженного в 0, 1М раствор Cr(NO)3, и серебра, погруженного в 0, 001М раствор AgNO3. Составьте схему гальванического элемента, напишите уравнения электродных процессов, рассчитайте ЭДС.
6. Составьте схемы электролиза водных растворов солей Na2S и CuSO4.
7. Сколько кулонов электричества надо пропустить через раствор соли AgNO3, чтобы выделить 1 г серебра? Какой объем газа при этом выделится на аноде?
8. Приведите схемы возможных процессов коррозии, идущих в сплаве Fe-Ni-Sn-Pb. Какие металлы в качестве протектора можно было бы использовать для защиты этого сплава от коррозии?
9. Напишите схему получения гальванического покрытия кобальтом на поверхности железа. Сколько времени надо вести электролиз током 2 А, чтобы получить покрытие массой 12 г?
10. Даны металлы: железо-свинец. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 7 и 2.
11. Физическая и химическая адсорбция.
12. Проявительная хроматография.
13. рН раствора КОН равен 8. Определите молярную концентрацию эквивалентов раствора.
14. Опишите дисперсную систему: пена. Приведите примеры аналогичных дисперсных систем.
15. Напишите формулу мицеллы, полученной при взаимодействии нитрата свинца (II) с избытком сульфата натрия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 14
1. Окисление аммиака протекает по уравнению
4NН3(г) + 3О2(г) = 2N2(г) + 6Н2О(ж) – 1528 кДж.
Определите энтальпию образования NН3(г) и NН4ОН, если теплота растворения NН3(г) в воде равна –34, 66 кДж.
2. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по реакции: РСl5(г) = РСl3(г) + Сl2(г); Δ Hº r = 92, 59 кДж.
3. Раствор, содержащий 8, 535 г нитрата натрия в 100 г воды, замерзает при -3, 04оС. Вычислите степень диссоциации NаNO3.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных марганцевого и свинцового электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Вычислите потенциал оловянного электрода в растворе, содержащем 2, 58 г SnCl2 в 800 мл раствора.
6. Составьте схемы электролиза водных растворов солей ZnSO4 и AgNO3.
7. Каким током (в амперах) велся электролиз раствора CuCl2, если за 1 час было получено 120 граммов меди? Сколько хлора при этом получилось?
8. Медный лист покрыт слоем свинца. Определите тип покрытия. Какой из металлов будет разрушаться при нарушении целостности покрытия? Какие коррозийные процессы будут идти, если изделие защитить железным протектором?
9. Изделие из бериллия защищено магниевым протектором. Сколько времени будет работать протектор массой 200 г, если сила тока коррозии 0, 001 А?
10. Даны металлы: никель-хром. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 8 и 2.
11. Уравнение адсорбции Гиббса, его анализ.
12. Фронтальная хроматография.
13. К 250 мл воды прибавили 50 мл 8%-го раствора КОН (ρ =1, 065 г/мл). Рассчитайте рН полученного раствора.
14. К какому типу дисперсных систем относится пыль. Приведите примеры аналогичных дисперсных систем.
15. Напишите формулу мицеллы, полученной при взаимодействии хлорида магния с избытком силиката калия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 15
1. На разложение 1 моля МnО2 по реакции 3МnО2(к) = Мn3О4(к) + О2 требуется 67 кДж теплоты. Вычислите Δ Hº f(Мn3О4).
2. Определите, при какой температуре начнется реакция восстановления Fe3O4: Fe3O4(к) + СО(г) = 3FeO(к) + СО2(г); Δ Hº r = 34, 55 кДж.
3. Раствор, содержащий 0, 834 г сульфата натрия Nа2SO4 в 1 кг воды, замерзает при -0, 028оС. Вычислите степень диссоциации соли.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных никелевого и ртутного электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Составьте схему гальванического элемента из стандартного водородного и цинкового электрода, погруженного в раствор ZnSO4, в котором С(Zn2+)=0, 01моль/л. Напишите уравнения электродных процессов, рассчитайте ЭДС.
6. Составьте схемы электролиза водных растворов солей SnBr2 и Al(NO3)3.
7. При электролизе раствора соли за 10 мин на катоде выделилось 0, 26 г хрома. Какова была сила тока? Какой продукт и в каком количестве выделился при этом на аноде?
8. Опишите процессы коррозии, идущие в сплаве Mn-Ni-Fe. Как пойдут процессы коррозии при покрытии этого сплава слоем меди после нарушения целостности покрытия?
9. Сколько времени будет работать цинковое покрытие на оцинкованном листе кровельного железа, если защищающая масса цинка 0, 4 кг, а сила коррозийного тока 0, 015 А?
10. Даны металлы: палладий-медь. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 10 и 1.
11. Поверхностно-активные вещества, особенность строения молекул.
12. Вытеснительная хроматография.
13. рН уксусной кислоты равен 3, 4. КД(СН3СООН) = 1, 86·10-5. Определите молярную концентрацию эквивалентов этой кислоты.
14. Опишите классификацию дисперсных систем в зависимости от размера частиц.
15. Напишите формулу мицеллы, полученной при взаимодействии нитрата хрома (III) с избытком гидроксида натрия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 16
1. Определите количество теплоты, которое выделится при образовании 112 л НСl (г) из простых веществ.
2. Определите возможность получения метана по реакции: СО(г) + 3Н2(г) = СН4(г) + Н2О(г) в стандартных условиях.
3. Раствор, содержащий 0, 53 г сульфита натрия в 200 г воды, замерзает при -0, 13оС. Вычислите степень диссоциации Nа2SO3 в этом растворе.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных магниевого и марганцевого электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Составьте схему гальванического элемента, при работе которого протекает реакция Ni + Pb(NO3)2 = Ni(NO3)2 + Pb. Напишите уравнения реакций, протекающих на электродах, рассчитайте ЭДС, если С(Ni2+) = 0, 01моль/л; С(Pb2+) = 0, 01 моль/л; j0(Ni2+/Ni) = -0, 23 B; j0(Pb2+/Pb) = -0, 13 В.
6. Составьте схемы электролиза водных растворов солей ZnSO4 и AgNO3.
7. Чему равна атомная масса четырехвалентного металла, если за 10 мин из раствора соли ток силой 5 А выделил 1, 517 г этого металла? Что это за металл? Назовите его.
8. Опишите процессы коррозии, идущие в сплаве Mn-Ni-Fe. Как пойдут процессы коррозии при покрытии этого сплава слоем меди после нарушения целостности покрытия?
9. Медная шина защищена цинковым протектором. Сколько времени будет работать протектор массой 15 кг, если сила коррозийного тока составляет 0, 04 А? Привести схему процессов коррозии.
10. Даны металлы: медь-олово. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 9 и 2.
11. Поверхностно-неактивные вещества, особен-ности строения их молекул.
12. Молекулярно-адсорбционная хроматография.
13. В 400 мл раствора NаОН содержится 0, 16 г NаОН. Вычислите рН раствора.
14. Способы получения дисперсных систем..
15. Напишите формулу мицеллы, полученной при взаимодействии нитрата серебра с избытком хлорида калия. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 17
1. Рассчитайте количество теплоты, которое выделится при сгорании: а) 1 л метана; б) 1 л пропана.
2. Рассчитайте, при какой температуре, 1000 К или 3000 К, возможна реакция:
ТiO2(к) + 2С(к) = Тi(к) + 2СО(г).
3. Вычислить понижение температуры замерзания раствора, содержащего 1 г АgNO3 в 50 г воды (α =59%).
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных цинкового и оловянного электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Электродвижущая сила Cu–Zn гальванического элемента равна 1, 04 В. Рассчитайте концентрацию ионов меди в медном электролите j Cu2+/Cu = 0, 34 В; j Zn2+/Zn = -0, 763 В. Концентрация цинкового электролита 0, 1 моль/л.
6. Составьте схемы электролиза водных растворов солей Na2S и CuSO4.
7. Сколько кулонов электричества надо пропустить через раствор соли AgNO3, чтобы выделить 1, 7 г серебра?
8. Какая из примесей более опасна для железа как конструктивного материала – медь или магний? Опишите коррозийные процессы, идущие в том и в другом случаях.
9. В качестве протектора для защиты медной шины использована железная болванка массой 25 кг. Сколько времени будет работать протектор, если сила коррозийного тока составит 0, 03 А? Составьте схему процесса коррозии.
10. Даны металлы: серебро-медь. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 7 и 1.
11. Изотерма адсорбции Фрейндлиха. Области применения.
12. Распределительная хроматография.
13. Рассчитайте рН 4%-го раствора НNО3 (ρ =1, 022 г/мл).
14. Что называется дисперсной системой, дисперсной фазой, дисперсионной средой. Приведите примеры дисперсных систем.
15. Напишите формулу мицеллы, полученной при взаимодействии карбоната натрия с избытком хлорида кальция. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 18
1. Вычислите стандартную энтальпию образования сахарозы С12Н22О11, если энтальпия реакции:
С12Н22О11 + 12О2(г) = 12 СО2(г) + 11Н2О(ж)
равна –5694 кДж.
2. Вычислите Δ Gº для следующих реакций:
а) 2NaF(к) + Cl2(г) = 2NaCl(к) + F2(г);
б) PbO2(к) + 2Zn(к) = Pb(к) + 2ZnО(к).
3. Кажущаяся степень диссоциации раствора, состоящего из 2, 925 г хлорида натрия NаCl и 50 г воды, равна 0, 8. Определите температуру замерзания раствора (Кк=1, 86 град·кг/моль).
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных кадмиевого и свинцового электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Вычислите ЭДС гальванического элемента, состоящего из стандартного водородного и медного электродов, если С(CuSO4)=0, 001М. Напишите уравнения реакций, протекающих на электродах.
6. Составьте схемы электролиза водных растворов солей FeCl2 и Hg(NO3)2.
7. При электролизе раствора соли ZnSO4 за 14 мин на катоде выделилось 1, 72г цинка. Какова была сила тока? Какой газ и в каком объеме выделился при этом на аноде?
8. Медный лист покрыт слоем свинца. Определите тип покрытия. Какой из металлов будет разрушаться при нарушении целостности покрытия? Какие коррозийные процессы будут идти, если изделие защитить железным протектором?
9. Трамвайный рельс подвергается коррозии блуждающим током силой 22 А. Через какой отрезок времени придется сменить рельс, если потеря массы железа при этом составит 12 кг?
10. Даны металлы: алюминий-никель. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 9 и 2.
11. Поверхностно-активные вещества (ПАВ), особенности строения молекул. Примеры применения ПАВ.
12. Хроматография. Классификация в зависимости от агрегатного состояния элюэнта (подвижной фазы).
13. К 400 мл 10%-го раствора КОН (ρ =1, 09 г/мл) добавили 800 мл воды. Вычислите рН и рОН раствора.
14. Способы получения дисперсных систем.
15. Напишите формулу мицеллы, полученной при взаимодействии сульфата цинка с избытком нитрата бария. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 19
1. Тепловой эффект реакции:
SО2(г) + 2Н2S(г) = 2S(к) + 2Н2О(ж)
равен 234, 5 кДж. Определите стандартную энтальпию образования Н2S.
2. Определите возможность самопроизвольного протекания реакции NН3(г) + НСl(г) = NН4Сl(г) при 30°С.
3. Вычислите степень кажущейся диссоциации 4%-го раствора хлорида калия, если этот раствор начинает замерзать при температуре -2оС.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных кадмиевого и ртутного электродов. Составьте схему гальванического элемента, напишите реакции на электродах.
5. Рассчитайте ЭДС гальванического элемента, составленного из железного и свинцового электродов, С(Fe2+)=C(Pb2+)=0, 1 М. Напишите уравнения процессов, протекающих на электродах j Fe3+/Fe = − 0, 44 B; j Pb2+/Pb = − 0, 13 B.
6. Составьте схемы электролиза водных растворов солей NiSO4 и MgBr2.
7. При прохождении через раствор соли трех-валентного металла тока силой 1, 5 А в течение 30 мин на катоде выделилось 1, 071 г металла. Вычислить атомную массу металла и назвать его.
8. Приведите схемы возможных процессов коррозии, идущих в сплаве Fe− Ni− Sn− Pb. Какие металлы в качестве протектора можно было бы использовать для защиты этого сплава от коррозии?
9. За сколько времени полностью разрушится за счет коррозии выброшенная консервная банка (Fe− Sn), если масса железа составляет 45 г (массой олова пренебречь), а сила коррозийного тока будет 0, 01 А?
10. Даны металлы: ртуть− олово. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 7 и 11.
11. Понятие об ионообменной адсорбции.
12. Распределительная хроматография.
13. Определите рН 0, 01 н раствора NН4ОН, если КNН 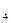 ОН = 1, 86·10-5.
ОН = 1, 86·10-5.
14. Опишите дисперсную систему: эмульсия. Приведите примеры эмульсий.
15. Напишите формулу мицеллы, полученной при взаимодействии гидроксида бария с избытком нитрата магния. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 20
1. Определите стандартную энтальпию образования Fe2O3, если в реакции 2Fe + Аl2O3 = Fe2O3 + 2Al на каждые 86 г Fe2O3 поглощается 426, 5 кДж теплоты.
2. Зная тепловой эффект реакции и стандартные энтропии образования веществ, определите Δ Gº реакции Н2(г) + СО2(г) = СО(г) + Н2О(ж), Δ Hº r = –2, 85 кДж. Сделайте вывод о возможности самопроизвольного процесса.
3. Определите температуру замерзания 0, 25 н раствора гидроксида натрия, плотность которого равна 1, 01 г/мл, а степень диссоциации 0, 8.
4. Вычислите ЭДС гальванического элемента, состоящего из стандартных железного и ртутного электродов. Составьте схему гальванического элемента, напишите реакции на электродах
5. Гальванический элемент состоит из метал-лического цинка, погруженного в 0, 1М раствор нитрата цинка и металлического свинца, погруженного в 0, 02М раствор нитрата свинца. Вычислить ЭДС элемента, написать уравнения электродных процессов, составить схему гальванического элемента.
6. Составьте схемы электролиза водных растворов солей AlI3 и CaBr2.
7. Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор соли AgNO3 в течение 30 мин. Какой продукт и в каком количестве выделится при этом на аноде?
8. Опишите схемы коррозийных процессов, идущих в месте соединения металлических листов железа, никеля и меди, соединенных алюминиевой заклепкой.
9. В сплаве Zn− Sn− Cu− Pb олово, в основном, сосредоточено в межкристаллитном слое. Через какой отрезок времени сплав перестанет работать как конструкционный материал, если масса олова составляет 1, 2% сплава (вес конструкции 1, 40 т), а сила коррозийного тока 0.04А? Приведите схемы возможных в сплаве процессов коррозии.
10. Даны металлы: золото− никель. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 8 и 3.
11. Адсорбционная способность почв, значение.
12. Ионообменная хроматография.
13. Вычислите рН 3, 12%-го раствора НСl (ρ =1, 015 г/мл).
14. Что называется дисперсной системой, дисперсной фазой, дисперсионной средой. Приведите примеры дисперсных систем.
15. Напишите формулу мицеллы, полученной при взаимодействии гидроксида натрия с избытком нитрата меди. Назовите составляющие компоненты мицеллы. Укажите, к какому электроду будут перемещаться гранулы этого золя в электрическом поле.
Вариант 21
1. Вычислите, сколько теплоты выделится при сгорании 165 л ацетилена (С2Н2), если продуктами сгорания являются оксид углерода (IV) и пары воды.
2. Сделайте вывод о возможности восстановления PbO2(к) цинком по реакции PbO2(к) + 2Zn(к) = Pb(к) + 2ZnО(к) в стандартных условиях.
3. Вычислите осмотическое давление 5%-го раствора ацетона в воде при 0оС. Плотность раствора 0, 90 г/мл.
4. Составьте схемы двух гальванических элементов, в одном из которых цинк является анодом, а в другом катодом.
5. Напишите уравнения реакций, протекающих при работе гальванического элемента:
Pb|Pb(NO3)2 0, 0001 М || Pb(NO3)2 1 М| Pb
Рассчитайте ЭДС, если j0 Pb2+/Pb = − 0, 13 В.
6. Составьте схемы электролиза водных растворов солей MnCl2 и Cu(NO3)2.
7. Вычислите сколько времени (в мин.) потребуется для получения 3 г золота при электролизе водного раствора AuCl3 силой тока 4 А.
8. Цинковое изделие содержит примеси алюминия и олова. Какая из этих примесей «вреднее» с точки зрения коррозии цинкового изделия? Опишите возможные процессы в этом изделии.
9. В качестве протектора для защиты от коррозии сплава Cu− Ni используется цинк. Опишите процессы, за счет которых идет разрушение цинка. За какое время разрушится протектор массой 10 кг, если сила коррозийного тока 0, 05 А?
10. Даны металлы: кобальт− висмут. Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии, если значения рН водной среды равны 4 и 11.
11. Значение сорбционных процессов в биоло-гических системах.
|
|