
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Краткие теоретические сведения. Цель работы: изучить спектр испускания и тонкую структуру спектра испускания атома натрия.
|
|
ИЗУЧЕНИЕ СПЕКТРА ИСПУСКАНИЯ НАТРИЯ
Цель работы: изучить спектр испускания и тонкую структуру спектра испускания атома натрия.
Оборудование: лампа с парами натрия, неоновая лампа, спектрограф ИСП-51, линза.
Краткие теоретические сведения
Каждый атом имеет множество уровней энергии. Переходы между ними порождают излучение с множеством различных частот. В результате возникает спектр излучения, который в видимой части представляет собой совокупность цветных линий на сплошном темном фоне.
Заполнение энергетических уровней электронами в атоме происходит
в соответствии с принципом Паули, согласно которому, на одном энергетическом уровне с определенными значениями квантовых чисел
n (главного), l (орбитального) и m (магнитного) могут находиться не более двух электронов с противоположно направленными спинами. Общая характеристика квантовых чисел приведена в методических указаниях к лабораторной работе «Изучение квантовых чисел».
Рассмотрим, какими особенностями обладают уровни энергии атома натрия. Его последняя незаполненная оболочка, имеющая главное квантовое число n = 3, содержит один электрон, называемый валентным. Согласно квантовой механике, набор электронных уровней будет полностью определяться орбитальным и спиновым «движениями» этого электрона, которые можно приближенно представить, как два круговых «тока». Каждый из этих «токов» обладает магнитным полем. Взаимодействие магнитных полей сопровождается либо взаимным притяжением, либо взаимным отталкиванием «токов». В первом случае энергия «токов» понижается, во втором повышается. В результате возникают два близких уровня энергии – дублет. Разность Δ Е между энергиями Е 1 и Е 2 этих уровней можно вычислить по известной формуле квантовой механики:
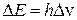 , (1)
, (1)
где h – постоянная Планка, h = 6, 62∙ 10-34 Дж∙ с; Δ ν – разность частот ν 1 и ν 2 для переходов электрона с дублетных уровней на какой-либо одиночный уровень энергии.
Можно дать более строгое объяснение возникновению дублетов.
Энергия уровней электрона с учетом орбитального и спинового движений определяется квантовым числом j полного момента импульса атома. Значения квантового числа j зависят от lАТ – орбитального и mSАТ – спинового квантовых чисел атома. А именно, j принимает значения в интервале
| lAT – mSAT | ≤ j ≤ lAT + mSAT. (2)
Для натрия значения чисел lAT и mSAT совпадают со значениями чисел lAT и mS валентного электрона соответственно. Спиновое число mS принимает два значения mS = ±1/2, а орбитальное число l – значения l = 0, 1, 2,... n – 1, где
n = 3. Таким образом, lAT принимает значения lAT = 0, 1, 2. Состояния атома
с квантовыми числами lAT = 0, 1, 2 обозначаются латинскими буквами S, P, D соответственно. Согласно формуле (2) для некоторых значений lAT и mSAT оказываются возможными два разных значения числа j, т. е. два уровня энергии – дублет. Действительно, при l = 0 и mSAT = ½ имеем j = ½. Здесь дублет сливается и возникает одиночный уровень. Далее, при lAT = 1 и mSAT = ½ из формулы (2) имеем j = ½, j = 3/2 – дублет. При l AT = 2 и mS AT = ½ из формулы (2) имеем j = 3/2, j = 5/2 – также дублет. Получившийся набор уровней и возможные переходы между ними представлены на рис. 1 и в табл. 1.
Таблица 1
| Тип уровней | Дублет | ||||
| Квантовое число mSAT | ½ | ||||
| Квантовое число lAT | |||||
| Максимальное количество значений квантового числа j | |||||
| Квантовое число j | ½ | ½ | 3/2 | 3/2 | 5/2 |
| Символ атомного состояния | 2 S 1/2 | 2 P 1/2 | 2 P 3/2 | 2 D 3/2 | 2 D 5/2 |
На рис. 1 в верхней строке указаны символы атомных состояний. Латинская буква обозначает определенное значение орбитального квантового числа lAT, индекс внизу справа – значение квантового числа j, индекс вверху слева – количество разных значений числа j при данных lAT и mSAT. Например, символ 2 P 1/2 означает (см. табл. 1), что lAT = 1, j = ½, всего возможны два значения j: j = 1+1/2 и j = 1–1/2. Уровни энергии с одинаковыми значениями квантового числа lAT изображены в одном столбце. Слева около каждого уровня указано главное квантовое число n. Возможные переходы в линии спектра натрия располагаются не произвольно, а группируются в серии (рис. 1). «Главную» серию образуют переходы с дублетных n 2 P 1/2, 3/2 уровней на основной одиночный 32 S 1/2 уровень. Эта серия начинается с самого яркого желтого дублета.
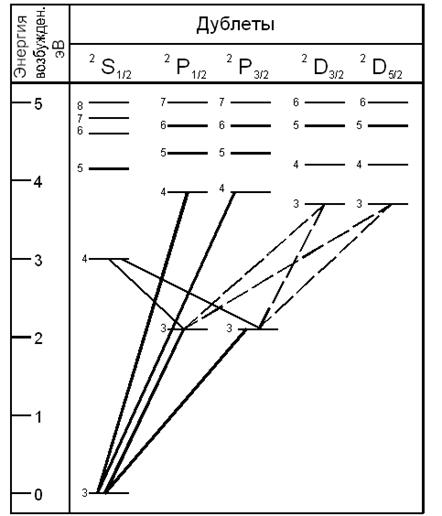
Рис. 1
Следующая серия – «резкая» – возникает при переходе электрона
с одиночных n 2 S 1/2 уровней на дублет 32 P 1/2, 3/2 уровней. Эта серия начинается с яркого красного дублета. Квантовое число n здесь принимает значения
n = 4, 5,..., а спектральные линии для этих двух серий имеют характер четких дублетов. Наконец «диффузная» серия с широкими размытыми линиями возникает при переходах электрона с дублетных n 2 D 3/2, 5/2 уровней на дублет n 2 P 1/2, 3/2. Здесь n = 3, 4, 5,....
Частоты ν всех наблюдаемых линий подчиняются формуле, полученной Ридбергом [1–3]
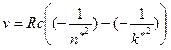 , (3)
, (3)
где R = 1, 097∙ 107 м-1 – постоянная Ридберга; c = 3∙ 108 м/с – скорость света
в вакууме. Числа n * и k *, которые не являются целыми, можно представить
в виде
n * = n + d, k *= k + d, (4)
где n – главное квантовое число верхнего уровня, k – главное квантовое число нижнего уровня, n, k принимают значения 1, 2,...; d – поправка Ридберга, различная для разных серий. Значения d указаны в табл. 2.
Таблица 2
| Состоя-ние | Главное квантовое число n, k | Поправка Ридберга d |
| S | –1.373 | |
| 4, 5, 6, 7 | –1.351 | |
| P | 3, 4 | –0.882 |
| D | 3, 4, 5, 6, 7 | –0.01 |
В данной работе необходимо экспериментально определить частоты наблюдаемого визуально спектра натрия без учета тонкой дублетной структуры спектра. Далее, по формулам (3) и (4) следует вычислить эти же частоты теоретически и сравнить результат с экспериментальными значениями.
С помощью формулы (1) можно получить экспериментальное значение энергии взаимодействия спинового и орбитального движений электрона. Для этого следует определить частоты линий тонкой структуры спектра, а именно, частоты линий, одного из дублетов. Например, красного. Затем следует сравнить полученный результат с теоретическим значением этой же энергии, который можно вычислить по формуле квантовой механики (см. [3]):
Δ Е = 582, 2 hс (z-a)4/ n 3 l (l +1), (5)
где h – постоянная Планка, c – скорость света в пустоте (см. формулу (1),
z = 11 – атомный номер натрия по таблице Менделеева, a = 7, 45 – поправка, связанная с частичным экранированием заряда ядра внутренними электронами натрия, n – главное квантовое число, l – орбитальное квантовое число дублетного уровня.
|
|