
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Линейчатые спектры по теории Бора
|
|
Рассмотрим движение электрона на орбите радиуса r. Так как в случае водорода заряд ядра по модулю равен заряду электрона, кулоновская сила притяжения электрона к ядру выразится равенством:
F = 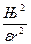 ,
,
где e – заряд электрона; e – диэлектрическая проницаемость среды,
для вакуума и воздуха e = 1.
Эта сила является центростремительной силой. Следовательно:
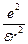 = = 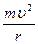 или или 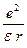 = mu2 = mu2
| (10) |
где m и u – масса и скорость электрона.
Потенциал поля, создаваемого ядром, определяется по законам электростатики формулой j = 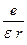 . Находящийся в этом поле электрон обладает потенциальной энергией:
. Находящийся в этом поле электрон обладает потенциальной энергией:
W = × j× е = – 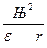 ,
,
Следовательно, в левой части равенства (10) мы получим потенциальную энергию (с противоположным знаком) двух притягивающихся равных зарядов –заряда ядра и электрона, т.е. потенциальную энергию Ep атома; а в правой части – удвоенную кинетическую энергию Ek –электрона. Полная энергия атома будет равна:
E = Ep + Ek = – 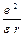 + + 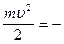 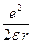 , ,
| (11) |
Определив из равенства (6) скорость u и подставив ее в равенство (10), найдем для n–ой орбиты:
rn = 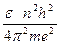
| (12) |
Подставляя это значение радиуса орбиты в формулу 11, получим полную энергию электрона и на n–ой орбите:
En2 = – 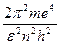
| (13) |
Аналогично этому для n1 –ой орбиты будем иметь:
En1 = – 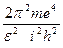
| (131) |
Если поставить эти значения энергии в равенство (7), то после преобразования получим:
n = 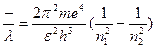
| (14) |
Сравнивая формулу (14) с (2), мы замечаем что обе формулы по виду совершенно одинаковы, если положить в полученном равенстве (14) n1 = 2
Очевидно:
cR = 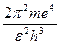 и En = cR и En = cR 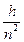
| (15) |
Вычисленные различными методами обе части равенства /15/ оказались численно равными. Таким образом, теория Бора хорошо объясняет сериальные формулы и, в частности, сериальную формулу Бальмера. Спектральные линии этой серии получаются, если электрон перескакивает на 2–ю орбиту: красная – с 3–ей, зеленая – с 4 –ой, синяя – с 5–ой, фиолетовая с 6–ой орбиты. В общем случае n1 показывает на какую орбиту перескакивает электрон, а n2– с какой орбиты перескакивает.
На рис.2 образование спектральных линий водорода показано графически для 3–х серии на 6 первых орбитах. Для орбит, начиная с 3–ей, показана только 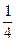 часть орбиты. Расстояние между орбитами показано не в масштабе.
часть орбиты. Расстояние между орбитами показано не в масштабе.
|
|