
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Жесткость воды
|
|
Жесткость воды обусловлена наличием в ней ионов двухвалентных металлов (Ca2+, Mg2+, Fe2+). Различают временную и постоянную жесткость.
Временная (или карбонатная) жесткость обусловлена наличием бикарбонатов Ме(НСО3)2, которые разлагаются в процессе кипячения:
Ca(HCO3)2 =¯ CaCО3 + CO2 + H2O
Fe(HCO3)2 =¯ Fe(OH)2 + 2СO2.
Твердый осадок покрывает поверхность водонагревательных систем, что снижает их нагревательную способность, эффективность теплопередачи.
Постоянная (или некарбонатная) жесткость обусловлена наличием растворимых хлоридов и сульфатов, которые при кипячении не разлагаются.
Сумма временной и постоянной жесткости дает общую жесткость:
Жобщ. = Жврем. + Жпост.
По ГОСТу жесткость воды оценивается в мг-экв/л (ммоль/л).
Одним из методов определения жесткости воды является титрование определенного объема воды раствором соляной кислоты известной концентрации. Применяются и весовые методы определения жесткости. Устранение жесткости сводится к удалению из воды ионов кальция и магния обычно путем перевода их в осадок в виде нерастворимых солей.
Пример 1. Вычислить временную жесткость, если в 2 л воды содержится 60, 12 мг ионов Ca2+ и 28, 37 мг ионов Mg2+.
Решение. Число ммоль эквивалентов Ca2+ вычисляем из соотношения:
1 ммоль Ca2+ – 20, 04 мг Ca2+
Х – 60, 12 мг Ca2+,  .
.
Число ммоль эквивалентов Mg2+определяем аналогично:
1 ммоль Mg – 12, 15 мг Mg2+
Х – 28, 37 мг,  .
.
Общее число ммоль эквивалентов ионов Ca2+ и Mg2+ составит в расчете на 1 л воды:
Ж = 3 + 2, 5 = 5, 5 ммоль/л.
Следовательно, согласно ГОСТу, вода умеренно жесткая.
Пример 2. Определить временную жесткость воды, если на титрование
100 мл образца воды, содержащей гидрокарбонат магния, израсходовано 8.10–3 л 0, 1Н раствора соляной кислоты.
Решение. При титровании жесткой воды соляной кислотой происходит следующая реакция:
Mg(HCO3)2 + 2HCl = MgCl2 + 2CO2 + 2H2O.
В соответствии с законом эквивалентов количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаковым:
Нр · Vр = Нк ·Vк,
где Нк и Нр – эквивалентные (нормальные) концентрации кислоты и раствора, Vк и Vр – объемы кислоты и раствора (л).
Откуда 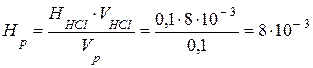 моль/л.
моль/л.
Так как жесткость измеряется в ммоль/л, то Ж = Нр ·1000 = 8·10-3 ·1000 = 8 ммоль/л, т.е. вода жесткая.
Пример 3. Вычислить постоянную жесткость воды, зная, что для удаления ионов кальция, содержащихся в 50 л этой воды, потребовалось прибавить к воде 10, 8 г безводной буры.
Решение. При действии буры на воду, содержащую сернокислый кальций, ионы кальция переходят в осадок вследствие реакции:
CaSO4 + Na2B4O7 =¯ CaB4O7 + Na2SO4.
Из уравнения реакции следует, что для осаждения ионов кальция в виде CaB4O7 на 1 эквивалент сернокислого кальция, т.е. на 1 г-экв ионов кальция надо взять 1 эквивалент буры или на 1 мг-экв ионов кальция - 1 мг-экв буры. Молярная масса эквивалента буры 202.1/2 = 101 г, следовательно, 1 мг-экв ее равен 101 мг. На осаждение ионов кальция, содержащихся в 50 л воды, израсходовано 10, 8 г или 10800 мг буры, что составляет:
 мг-экв.
мг-экв.
Поскольку, согласно закону эквивалентов, вещества взаимодействуют в эквивалентных соотношениях, столько же мг-экв ионов кальция будет содержаться в 50 л воды.
Отсюда жесткость воды равняется 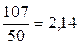 ммоль-экв/л.
ммоль-экв/л.
326. Присутствие каких солей в природной воде обуславливает ее жесткость? Почему употребление жесткой воды при стирке белья вызывает большой расход мыла? Отразится ли на расходе мыла присутствие в воде хлористого кальция?
327. Почему жесткость, обусловленная присутствием в воде гидрокарбонатов кальция или магния, называется временной? Какие химические реакции будут происходить: а) при кипячении жесткой воды, содержащей Ca(HCO3)2; б) при добавлении к ней соды; в) при добавлении к ней едкого натра?
328. Какую массу Na2CO3 надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 ммоль-экв?
329. Как временная, так и постоянная жесткость воды может быть устранена прибавлением к воде соды. Можно ли заменить соду: а) карбонатом калия; б) гидроксидом бария, который хорошо растворим в воде? Ответ подтвердите уравнениями реакций.
330. Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 см3 воды, требуется 15 см3 раствора HCl с эквивалентной концентрацией, равной 0, 08.
331. Чему равняется жесткость воды, если для устранения ее к 100 мл воды потребовалось прибавить 15, 9 г соды?
332. Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 ммоль-экв. Какой объем 0, 1н раствора HCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3 этой воды?
333. Введением каких ионов в природную воду можно устранить:
а) временную жесткость воды; б) постоянную ее жесткость?
334. В 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость воды.
335. Сколько граммов гашеной извести надо прибавить к 1000 л воды, чтобы устранить ее временную жесткость, равную 2, 86 ммоль-экв/л?
336. Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21, 2 г карбоната натрия?
337. Вычислите временную жесткость воды, зная, что на реакцию с гидрокарбонатом, содержащимся в 100 мл этой воды, израсходовано 5 мл 0, 1н раствора НСl.
338. Какие ионы надо удалить из природной воды, чтобы сделать ее мягкой? Введением каких ионов можно умягчить воду? Составьте уравнения реакций. Какую массу Ca(OH)2 надо прибавить к 2, 5л воды, чтобы устранить ее жесткость, равную 4, 43 ммоль-экв?
339. Жесткость воды, содержащей только гидрокарбонат кальция, равна 1, 78 ммоль-экв. Определите количество гидрокарбоната в литре этой воды.
340. Какую массу карбоната натрия надо прибавить к 0, 1 м3 воды, чтобы устранить жесткость, равную 4 ммоль-экв/л?
341. Какова временная жесткость воды, в литре которой содержится 0, 146 г гидрокарбоната магния?
342. К 100 л жесткой воды прибавили 12, 95 г гидроксида кальция. Насколько понизилась карбонатная жесткость?
343. Вычислите постоянную жесткость воды, зная, что для удаления ионов кальция, содержащихся в 50 л этой воды, потребовалось прибавить к воде 10, 8 г безводной буры.
344. Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0, 292 г гидрокарбоната магния и 0, 2025 г гидрокарбоната кальция?
345. Путем анализа было установлено, что в одном литре исследуемой воды содержится 42 мг ионов магния и 112 мг ионов кальция. Вычислите общую жесткость воды.
|
|