
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Количественные законы электролиза
|
|
Реакции электролиза являются такими же химическими реакциями, как и все остальные, т.е. по ним можно производить стехиометрические расчеты. Но для них существуют специфичные количественные соотношения, названные в честь ученого, установившего эти законы.
Законы Фарадея.
1. Масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита:
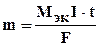 , (10.5)
, (10.5)
где m - масса выделившегося или подвергшегося превращению вещества,
МЭК - эквивалентная масса вещества (г/моль экв),
I - сила тока (а), t - время (с),
F - постоянная Фарадея (96500 Кл /моль экв), т. е. количество электричества, необходимое для выделения или превращения одного моля эквивалента вещества. 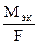 - электрохимический эквивалент.
- электрохимический эквивалент.
При прохождении одного и того же количества электричества через раствор или расплав электролита массы (объемы) веществ, выделившихся на электродах, прямо пропорциональны их химическим эквивалентам.
Пример 6. Ток силой 6 А проходил в течение 1, 5 часа через разбавленный раствор H2SO4. Вычислить массу разложившейся воды и объемы H2 и O2, выделившихся на электродах (0 °C и 760 мм рт. ст.).
Решение. В растворе кислота диссоциирует по уравнению: H2SO4 = 2Н+ + SO42-.
 |
Катод (-): 2Н+ + 2ē = Н2 2
Анод (+): 2H2O - 4ē = O2 + 4H+. 1,
2H2O = 2Н2 + О2.
Процессы электролиза подчиняются закону Фарадея (10.5):
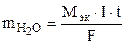 =
= 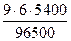 = 3, 02 г.
= 3, 02 г.
При вычислении объемов выделившихся газов представим уравнение (10.5) в следующей форме:
V = 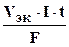 , (10.6)
, (10.6)
где V - объем выделившегося газа, VЭК - его эквивалентный объем.
Поскольку при н.у. VЭК водорода равен 11, 2 л/моль, а кислорода - 5, 6 л/моль, то получаем:
V(H2) = 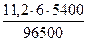 = 3, 76 л, V(О2) =
= 3, 76 л, V(О2) = 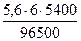 = 1, 88 л.
= 1, 88 л.
Пример 7. При электролизе раствора сульфата меди на аноде выделилось 350 мл кислорода (н.у.). Сколько граммов меди выделилось при этом на катоде?
Решение. CuSO4 = Cu2+ + SO42-. Согласно правилам, сформулированным выше:
 катод: Cu2+ + 2ē = Cuо 2
катод: Cu2+ + 2ē = Cuо 2
анод: 2H2O - 4ē = O2 + 4H+ 1
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4.
Эквивалентный объем кислорода при н.у. составляет 5, 6 л, следовательно, 350 мл составляет 0, 0625 (0, 35/5, 6) моль эквивалентов. Значит, столько же моль эквивалентов меди выделится и на катоде (2-й закон Фарадея). Отсюда находим массу меди:
m = n·Mэк = 0, 0625·31, 77 = 1, 98 г (Мэк(Cu) = MCu·1/2 = 63, 54/2 = 31, 77 г/моль экв).
|
|