
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Зависимость скорости от температуры
|
|
Повышение температуры ускоряет большинство химических реакций. Первоначально Вант-Гофф экспериментально установил, что при увеличении температуры на каждые 10 градусов скорость возрастает в 2 ¸ 4 раза ( правило Вант-Гоффа ). Это соответствует степенной зависимости скорости от температуры:
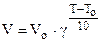 , (6.6)
, (6.6)
где Т > Т0, g - температурный коэффициент Вант-Гоффа.
Однако это уравнение теоретически не обосновано; экспериментальные данные лучше описываются экспоненциальной функцией (уравнение Аррениуса):
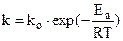 , (6.7)
, (6.7)
где А - предэкспоненциальный множитель, не зависящий от Т, Еа - энергия активации химической реакции (кДж/моль), R - универсальная газовая постоянная; k – константа скорости.
Не все столкновения молекул ведут к их взаимодействию. Чтобы произошла реакция, сталкивающиеся молекулы должны обладать энергией, превышающей среднее значение энергии всех молекул. Такие молекулы называют активными. Энергию, необходимую для активирования молекул, называют энергией активацией данной реакции.
При наличии экспериментальных данных для двух температур ko и Еа легко теоретически найти:
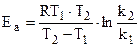 (6.8)
(6.8)
Скорость химической реакции в значительной мере зависит от энергии активации. Для подавляющего большинства реакций она лежит в пределах от 50 до 250 кДж/моль. Реакции, для которых Еа > 150 кДж/моль, при комнатной температуре практически не протекают.
Пример 4. Константа скорости реакции первого порядка 2О3 = 3О2 при 0 °С равна 1, 4∙ 102, а при 27 °С 1, 38∙ 103 с–1. Найти скорость реакции при 0 °С и концентрации озона 0, 1 моль/л и температурный коэффициент скорости реакции.
Решение. По условию реакция имеет первый порядок, поэтому кинетическое уравнение имеет вид:
V = k[О3]1 = 1, 41·102 0, 1 = 14, 1 с-1.
Температурный коэффициент находим из выражения 6.6:
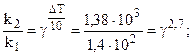
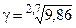 = 2, 3.
= 2, 3.
Пример 5. Определить энергию активации реакции и ее температурный коэффициент, если при 398 и 600 0C константы скорости равны, соответственно, 2, 11× 10-4 и 6, 25× 10-1.
Решение. Еа по двум значениям может быть рассчитана по формуле 6.8:
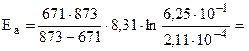 192б33 Дж/моль = 192, 63 кДж.
192б33 Дж/моль = 192, 63 кДж.
Температурный коэффициент находим из выражения (6.6), т.к. V µ k:
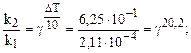
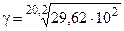 = 1, 48.
= 1, 48.
|
|