
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 5. Химическое равновесие
|
|
Вопросы для самопроверки
1. В обратимой реакции A + 2B ⇆ D + C равновесные концентрации реагирующих газов равны: [A] = 0, 06; [B] = 0, 12; [C] = 0, 216 моль/л. Рассчитайте константу равновесия реакции и начальную концентрацию В.
Как изменится значение константы равновесия при повышении давления
(1 – увеличится, 2 – уменьшится, 3 – не изменится)
2. С ростом температуры значение константы равновесия реакции
Н2О(г) D Н2 + ½ О2 возрастает. Каков знак ∆ Но этой реакции?
1) ∆ Но > 0; 2) ∆ Но < 0; 3) По данным задачи нельзя определить.
3. Для обратимой реакции 2SO2 + O2 D 2SO3(г); DHо = –198, 8 кДж
установите соответствие между внешним воздействием и его влиянием на смещение равновесия:
| Внешние воздействия | Смещение равновесия | ||
| А) | Повышение температуры | 1) | В сторону продуктов |
| Б) | Увеличение давления | 2) | В сторону реагентов |
| В) | Повышение концентрации O2 | 3) | Не смещается |
| Г) | Поглощение сорбентом SO3 | ||
| Д) | Введение катализатора |
Ответ приведите набором пяти цифр без пробелов и запятых между ними.
4. Как изменяется константа равновесия при повышении температуры для реакции:
CO(г) + H2O(г) = H2(г) + CO2(г) ∆ Но = -41 кДж?
1) не изменяется 2) увеличивается 3) уменьшается
5. В каком направлении смещается равновесие обратимой эндотермической реакции при повышении температуры:
2SO3 (г) ⇆ 2SO2(г) + O2(г)?
1) вправо 2) влево 3) не смещается
6. Укажите, равновесие каких реакций
1) NH4NO3(т) D N2O(г) + 2H2O(г); ∆ Но = –767 кДж;
2) 2H2(г) + O2(г) D 2H2O(г); ∆ Но = –483, 6 кДж;
3) N2(г) + O2(г) D 2NO(г); ∆ Hо = 180 кДж;
4) I2(к) + H2S(г) D 2HI(г) + S(т); ∆ Но = 30 кДж;
смещается влево: при повышении температуры
при уменьшении давления
Тема 6. ХИМИЧЕСКАЯ КИНЕТИКА
Цели: 1. Знать влияние различных факторов на скорость реакции.
2. Записывать закон действующих масс для скорости реакции (кинетическое уравнение).
3. Определять порядок и молекулярность простых (элементарных) и сложных реакций.
4. Объяснять зависимость скорости реакции от температуры с использованием правила Вант-Гоффа и уравнения Аррениуса.
5. Давать определение катализа, объяснять причину ускорения реакций в присутствии катализаторов.
Основные понятия и представления
Кинетика – раздел химии, изучающий протекание реакции во времени, зависимость скорости реакции от различных факторов, а также механизм реакции.
Скорость реакции – число элементарных реакций между взаимодействующими частицами в единицу времени. (Vх.р), измеряется изменением концентрации какого-либо реагента или продукта в единицу времени:
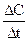 (Dt ® 0) =
(Dt ® 0) = 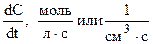 . (6.1)
. (6.1)
При этом скорости изменения концентраций всех продуктов и реагентов однозначно связаны между собой. Для реакции
аА + bВ +.... = сС + dD +...
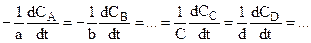 (6.2)
(6.2)
Под механизмом реакции в кинетике понимают путь реакции, т.е через какие стадии протекает процесс.
Простые (элементарные) реакции - реакции, протекающие в одну стадию и описываемые уравнением скорости реакции или кинетическим уравнением.
Сложные реакции - реакции, протекающие через несколько последовательных или параллельных стадий. В этом случае кинетическое уравнение описывает самую медленную (лимитирующую) стадию.
На скорость реакции влияют многие факторы: концентрация реагентов, температура, давление, катализаторы, внешние воздействия, например излучения и др.
|
|