
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергия Гиббса
|
|
Если процесс протекает так, что DН = 0 (изолированная система), то изменение энтропии становится его единственной движущей силой. Причем чем выше температура, тем сильнее проявляется энтропийный фактор (ТDS). При условии DS = 0 единственной движущей силой химической реакции является убыль энтальпии - энтальпийный фактор - DН.
Таким образом, в химических реакциях одновременно проявляются две тенденции:
1) стремление системы к образованию связей в результате взаимного притяжения частиц, что приводит к увеличению порядка и сопровождается понижением энергии системы (DН);
2) стремление к диссоциации сложных частиц на простые, увеличению числа частиц, увеличению беспорядка и возрастанию энтропии (TDS).
Если эти тенденции уравновешивают друг друга, то DН = TDS.
При неравенстве этих величин их разность может служить мерой химического сродства реагентов:
DG = DH - TDS. (4.5)
Она носит название энергии Гиббса.
При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается (DG< 0) (вторая формулировка II закона термодинамики).
Из уравнения (4.5) вытекает, что наибольшее сродство веществ друг к другу проявляется в реакциях, протекающих с DН < 0 и DS > 0 (протекают при любых температурах).
Чем меньше величина DGох.р, тем дальше система находится от состояния химического равновесия и тем более она реакционноспособная.
Изменение энергии Гиббса (DGх.р.) в результате химической реакции можно найти по стандартным энергиям Гиббса образования веществ (DGоƒ ) (табл. 4.1):
DGох.р. = å nпрод·DGоƒ, прод - å nреагентов·DGоƒ , реагентов. (4.6)
При этом DGоƒ простых веществ так же, как DНоƒ , равны нулю.
Таким образом, критерий направления процессов можно записать так:
равновесие - DG = 0; DН = Т·DS;
(реакция может протекать как в прямом, так и в обратном направлении);
самопроизвольный процесс
в прямом направлении DG < 0; DН - Т·DS < 0;
не может протекать в прямом направлении
(возможен обратный процесс) DG > 0; DН - Т·DS > 0.
Переход DG через ноль можно определить из соотношения
DН = Травн·DS . Отсюда 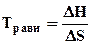 . (4.7)
. (4.7)
Таким образом, энергия Гиббса зависит от характера реакции (значения DН и DS), а для многих реакций и от температуры. Зная величины DН и DS, можно рассчитать DG и, соответственно, предсказать возможность или невозможность самопроизвольного протекания реакции, а также влияние температуры на направление процесса.
Пример 6. Пользуясь данными табл. 4.1, установить возможность или невозможность восстановления диоксида титана в стандартных условиях по реакции:
TiO2 (к) + 2С(графит) = Ti (к) + 2СО(г).
DG0 (кДж/моль) -888, 6 0 0 -137, 1
Решение Используя уравнение (4.6), рассчитываем DG0х.р.:
DG0х. р. = 2DG0ƒ (СО) - DG0ƒ (TiO2) = 2·-137, 1 - (-888, 6) = 614, 4 кДж.
Поскольку DG0х.р > 0, восстановление TiO2 при 298 К невозможно. Согласно закону сохранения энергии для обратного процесса окисления титана оксидом углерода
DG0 = - 614, 4 кДж, т.е. обратный процесс возможен.
Пример 7. Реакция восстановления Fe2O3 водородом протекает по уравнению:
Fe2O3 (к) + 3H2 = 2Fe (к) + 3Н2О(г), DH0х..р. = + 96, 6кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии
DS0 = 0, 1387 кДж/моль·К? При какой температуре начнется восстановление Fe2O3?
Решение. Вычисляем DG0 реакции по (4.5):
DG0x.p. = DH0 -TDS0 = 96, 6 - 298·0, 1387 = 55, 3 кДж.
Так как DG > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру согласно уравнению (4.7), при которой DG = 0 (состояние равновесия); Тогда
DH0 = T·DS0, отсюда 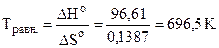 .
.
Следовательно, при температуре примерно 696, 5 К начнется реакция восстановления Fe2O3.
Пример 8. При некоторой температуре Т эндотермическая реакция А ® В практически идет до конца. Определить знак DS реакции.
Решение. То, что реакция протекает самопроизвольно в прямом направлении, указывает на то, что DG < 0. Так как реакция эндотермическая, то DH > 0. Из уравнения (4.5)
DG = DH - T·DSследует, что ·DS0 должна быть > 0.
Пример 9. Не проводя расчётов, определить, какие из перечисленных процессов возможны в изолированной системе:
а) 2NH3 (г) = N2 (г) + 3H2 (г), б) NО (г) + NО2 (г) = N2О3 (к),
в) 2S(к) + 3O2 (г) = 2SO3 (г).
Решение. В изолированной системе (DH = 0) критерием самопроизвольного протекания процесса является увеличение энтропии. Учитывая, что газообразные вещества имеют большую энтропию, чем жидкие и твердые, заключаем, что с увеличением энтропии протекает реакция (а) (из 2 моль газа получается 4 моль). Реакции б) и в) протекают в обратном направлении (в реакции б) из газообразных веществ получилось кристаллическое, а реакция (в) сопровождается уменьшением объема газа).
Пример 10. Указать, какие из реакций образования оксидов азота и при каких температурах (высоких или низких) могут протекать самопроизвольно в стандартных условиях:
а) 2N2 (г) + О2 = 2N2О (г) , DHО298 > 0.
б) 2N2 (г) + О2 = 2NО (г) , DHО298 > 0.
в) NО (г) + NО2 (г) = N2О3 (к), DHО298 < 0.
Решение. а) определим изменение энтропии: так как количество газа уменьшается с трех молей до двух, энтропия уменьшается и DS < 0. Возможность протекания реакции определяется энергией Гиббса (DG < 0). Из анализа уравнения (4.5) DG = DH - TDS следует, что при DH > 0 и DS < 0 DG > 0 при любых температурах, т.е. эта реакция невозможна при любых температурах;
б) аналогично реакции (а);
в) для этой реакции энтропия уменьшается, так как из газообразных веществ получается кристаллическое, т.е. DS < 0. Если DH < 0 и DS < 0, то реакция возможна при достаточно низких температурах, при этом величина DH будет превышать по абсолютному значению член TDS и DG < 0.
Из соотношения (4.5) видно, что самопроизвольно могут протекать и эндотермические процессы, для которых DH > 0. Это возможно при высоких температурах, когда DS > 0. При низких температурах знак DG определяется в основном энтальпийным фактором, т.е. DH < 0.
|
|