
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Удк 538. 1
|
|
МІНІСТЕРСТВО АГРАРНОЇ ПОЛІТИКИ УКРАЇНИ
ПОЛТАВСЬКА ДЕРЖАВНА АГРАРНА АКАДЕМІЯ
Кафедра загальної та біологічної хімії
КУРС ЛЕКЦІЙ З
„ФІЗИКО-ХІМІЧНИХ МЕТОДІВ АНАЛІЗУ”
Для студентів денної форми навчання
напряму підготовки – 6.090.101 " Агрономія"
Полтава - 2014
УДК 538.1
Короткова І.В. Курс лекцій з „Фізико-хімічних методів аналізу” для студентів факультету агротехнологій та екології напряму підготовки – 6.090.101 " Агрономія ". Полтава: 2014. – 21 с.
Скорочений курс лекцій включає найбільш вагомі теми дисципліни. Наприкінці кожної теми наведені контрольні запитання, які допомагають перевірити отриманні знання. Для студентів вищих аграрних навчальних закладів ІІІ-ІV рівнів акредитації напряму підготовки – 6.090.101 " Агрономія".
Укладач:
Короткова Ірина Валентинівна
доцент кафедри загальної та біологічної хімії Полтавської державної аграрної академії, кандидат хімічних наук.
Рецензенти:
Шиян Надія Іванівна – завідувач кафедри хімії та методики викладання хімії Полтавського державного педагогічного університету ім.В.Г.Короленка, доктор педагогічних наук, професор.
Крикунова Валентина Юхимівна – завідувач кафедри загальної та біологічної хімії Полтавської державної аграрної академії, кандидат хімічних наук.
Рекомендовано до видання кафедрою загальної та біологічної хімії (Протокол № 1 від 27 серпня 2014 року) та науково-методичною радою напряму підготовки " Агрономія" Полтавської державної аграрної академії (Пр..№ 1 від 05.09. 2014 року).
Лекція 1.
Тема: Фізико-хімічні методи аналізу.
План:
1. Загальна характеристика фізико-хімічних методів аналізу.
2. Спектральні методи аналізу.
3. Фізичні основи спектральних методів аналізу. Основні закони.
4. Принципи електронної спектроскопії.
В останні роки для дослідження будови органічних сполук та визначення концентрацій неорганічних та органічних речовин поряд з хімічними методами широко використовують фізичні (інструментальні) методи. В деяких випадках інструментальні методи відіграють вирішальну роль при встановленні будови речовини.
За допомогою фізичних методів можна встановити:
а) відстані і кути між атомами в молекулі;
б) взаємне розташування атомів у просторі;
в) внутрішньо молекулярні і міжмолекулярні взаємодії.
Перевагою інструментальних методів над хімічними також є те, що:
1. в процесі дослідження речовина, як правило, не змінюється і не витрачається, що дозволяє використовувати ці методи для вивчення будови нестійких і малостійких речовин;
2. вирішувати структурну задачу при наявності невеликих кількостей речовини.
До найважливіших фізичних методів дослідження будови відносяться:
1) спектральні (ІЧ-спектроскопія, спектроскопія комбінаційного розсіювання (КР), УФ-спектроскопія і спектроскопія у видимій області), спектроскопія ядерного магнітного резонансу (ЯМР), мас-спектрометрія;
2) дифракційні методи (рентгенографія, електронографія, нейтронографія).
Кожен метод має обмежені можливості і однозначно не може вирішити структурну задачу, тому найчастіше для вивчення структури використовують комплекс фізичних методів.
ІІ. Спектральні методи аналізу.
В основі методів лежить здатність органічних речовин поглинати електромагнітне випромінювання в певному діапазоні електромагнітного спектру. В залежності від довжини хвилі електромагнітне випромінювання поділяється на декілька областей:
1) рентгенівську λ = 10-3 – 10 нм;
2) УФ: дальня λ = 10 – 200 нм;
ближня λ = 200 – 400 нм;
видима λ = 400 – 800 нм;
3) ІЧ λ = 0, 8 – 1000 мкм;
4) мікрохвильову λ = 0, 1 – 100 см;
5) радіочастотну λ = 1 – 1000 м.
Поглинання молекулою електромагнітного випромінювання відбувається квантами (hν). При цьому молекула переходить з основного енергетичного стану в збуджений.
Поглинання енергії в УФ і видимій ділянках спектру використовується молекулою на збудження електронів, тому спектроскопія, що вивчає електронні переходи в молекулах, називається електронною спектроскопією.
Поглинання енергії ІЧ діапазону витрачається речовиною на збудження коливань атомних груп в молекулі і є предметом вивчення ІЧ-спектроскопії.
Радіочастотне випромінювання зумовлює зміну спінового стану атомних ядер, яке вимірюється спектроскопією ядерного магнітного резонансу.
В реальних умовах поглинання речовиною енергії відбувається не строго при певній довжині хвилі, яка відповідає енергії переходу молекули в збуджений стан, а в деякому інтервалі довжин хвиль – у вигляді так званої спектральної смуги.
Для характеристики спектральних смуг використовують 3 основних параметри:
а) положення максимуму (λ max);
б) інтенсивність поглинання в максимумі (Ε max);
в) напівширину полоси поглинання(Ε max/2).
У сукупності спектральні смуги утворюють спектр поглинання речовини. Кожній речовині властивий свій характерний спектр, що дозволяє її ідентифікувати. Положення спектру відображує специфічні властивості речовини і дозволяє встановити її природу, а інтенсивність спектральної смуги пов’язана з кількістю досліджуваної речовини.
ІІІ. Фізичні основи спектральних методів.
Як відомо, електромагнітна хвиля – це три взаємно перпендикулярних вектори: вектор швидкості, електричний і магнітний вектори. Основною характеристикою електромагнітної хвилі є довжина хвилі λ або частота ν. Для того, щоб зрозуміти суть методів, необхідно знати причини виникнення спектрів поглинання і випромінювання.
Основним принципом взаємодії випромінювання (світла) і речовини є принцип квантованого поглинання енергії: співвідношення Бора Δ Е =hν – зв’язує енергію поглинутого випромінювання і частоту (ν) або довжину хвилі (λ), тому що ν =1/ λ.
Один з фундаментальних законів, який описує цей процес, є закон Гротгуса (1818 р.) і Дрейпера (1843 р.): тільки те світло, яке поглинається речовиною здатне викликати в ньому будь-які перетворення.
Компонентами системи, які поглинають, можуть бути не тільки реагуючі речовини, а і сенсибілізатори – сполуки, які поглинають світло, але самі участі в реакції не приймають. Поглинання світла речовиною відбувається лише в тому випадку, коли енергія діючого кванта світла відповідає різниці енергій основного і збудженого станів молекули (Е1 − Е0 = hν). Квант світла найчастіше характеризують не частотою ν, а довжиною хвилі λ (нм) або хвильовим числом ν (см-1): 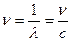 ;
; 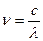 , де с – швидкість світла (с = 3∙ 108 м/с).
, де с – швидкість світла (с = 3∙ 108 м/с).
Другий фундаментальний закон – закон фотохімічної еквівалентності Штарка – Ейнштейна: кожний поглинутий квант світла здатний активувати лише одну молекулу. Після відкриття двохквантових фотохімічних процесів це формулювання набуло уточнення: кожен поглинутий квант світла зумовлює лише один елементарний акт.
Типи змін в молекулі залежать від енергії поглинутого випромінювання. Процес поглинання молекулою кванта світла і збудження молекули відбувається у випадку, коли наявна взаємодія між електричним вектором падаючого світла (електромагнітної хвилі) і електронною хмарою молекули. Відбувається це лише коли енергія кванта світла hν відповідає різниці енергій дискретних рівнів молекули: hν = Е1 – Е2.
Розрізняють: основний стан (тільки синглетний, тобто. згідно з принципом Паулі, молекула має тільки спарені електрони (2S+1=2.0+1=1) і збуджений стан - синглетний і триплетний (2S+1=2.1+1=3).
Кожний енергетичний рівень містить набір коливальних і обертальних рівнів. При переході молекули S0 → S1 відбувається зміна енергії і коливальних і обертальних рівнів. Спектри, що при цьому отримуємо, називаються електронними, але по своїй природі вони є електронно-коливально-обертальними. Енергія, що при цьому поглинається, тобто спектри, які відповідають електронним переходам, розташовані в видимій та УФ ділянках електромагнітної хвилі, спектри які відповідають коливанням ядер, обертанням молекул – в ІЧ-ділянці. Кожна однорідна система має здатність поглинати випромінювання певних довжин хвиль.
| Діапазон спектру | Енергія, єВ | |
| УФ-область | > 10 | електронні переходи |
| Видима область | 1 - 10 | електронні переходи |
| ІЧ-область | < 1 | коливання ядер, обертання молекул |
ІV. Електронна спектроскопія вивчає спектри поглинання в УФ- (УФ спектроскопія) і видимому (спектроскопія в видимій області) діапазоні електромагнітного випромінювання. Походження цих спектрів зумовлене електронними переходами в молекулах і тому їх називають електронними спектрами.
При поглинанні молекулою енергії, що відповідає енергетичній різниці двох її електронних станів: Е1 – Е2 = hν, електрони, що утворюють σ - та π -зв’язки, а також неподілені електрони (n-електрони) збуджуються і переходять на більш високі енергетичні рівні. Згідно теорії молекулярних обріталей (МО) електронні переходи розглядають як переміщення їх зі зв’язуючих МО на розпушуючі. При цьому можливі 4 типи електронних переходів:
σ → σ *
π → π *
n→ σ *
n→ π *
Переходи σ → σ * спостерігаються лише в органічних сполуках, які містять лише σ -зв’язки – алкани, циклоалкани (область менше 200 нм).
Якщо до складу сполуки входять гетероатоми (N, O, S) полоси поглинання можуть бути зумовлені σ → σ * та n→ π *переходами – спирти R-OH (область ~180 нм).
В сполуках з кратними зв’язками можливі: σ → σ *, n→ σ *, n→ π * та π → π * переходи. Енергія збудження π -електронів кратних зв’язків менша за енергію збудження електронів простих зв’язків, тому смуги, що відповідають π → π * переходам знаходяться в області 180-190 нм.
Атомна групіровка, що містить одну або декілька кратних зв’язків, називається хромофором, вони зумовлюють смуги поглинання від 200 до 1000 нм: > С=С<, С≡ С, С=О, С=N, N=O, S=O і т. ін..
Поряд з енергією поглинання, електронні спектри характеризуються інтенсивністю поглинання (ε). Інтенсивність поглинання визначає вірогідність електронного переходу кожного типу, тобто, переходи, що відбуваються з більшою вірогідністю мають більшу інтенсивність поглинання і навпаки
На положення смуг поглинання можуть впливати:
· природа розчинника
· температура
· природа розчиненої речовини
· просторові ефекти.
Це може призвести до зсуву смуги поглинання в довгохвильову частину електромагнітного спектру – батохромний зсув або в короткохвильову – гіпсохромний зсув.
Яку інформацію дає УФ-спектроскопія?
1. встановлення будови молекул (ідентифікація, структурні дослідження, розрізнення просторових конфігурацій);
2. визначення концентрації речовини.
Приклади спектральних смуг:
· насичені альдегіди і кетони: слабка n→ π * смуга в області 270-290 нм;
· арени: π → π * переходи для бензенового кільця спостерігаються у вигляді трьох груп смуг в областях 180, 200, 230-260 нм.
· Дієнові сполуки: за основу беруть дві початкові системи – спряжені подвійні зв’язки, 214 нм і бензинове кільце 253 нм.
При додаванні замісників до подвійних зв’язків:
· Якщо ланцюг спряження збільшується ще на один подвійний зв'язок – слід додати 30 нм;
· Якщо додається алкільний замісник або цикл – додають 5 нм;
· Якщо екзоциклічний подвійний зв'язок – додають 5 нм.
Де в результаті повинна знаходитись смуга поглинання?
Зо основу взято 214 нм (спряжений подвійний зв’язок) + 20 нм (алкільний замісник) + 10 нм (два екзоциклічних подвійних зв’язки) – отже, смуга поглинання розташована в області 244 нм.
За допомогою УФ-спектроскопії можна також розрізняти просторові конфігурації молекул. Транс-ізомери мають більш інтенсивні смуги в порівнянні з цис- і розташовані в більш довгохвильовій частині електромагнітної хвилі. Так, для коричних кислот: цис-ізомер має смугу поглинання в області 264 нм, а трас-ізомер – 273 нм. Для стильбену: цис-ізомер – 280 нм, транс-ізомер – 295 нм.
Лекція 2.
|
|