
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лекция № 3. 6 страница
|
|
3. Широкое разнообразие белков. На основе 35000 генов синтезируются около 5000000 белков.
В настоящее время нельзя сказать точно, что изучать важнее - геном или белковый состав
организма.
ПРОТЕОМИКА - отрасль молекулярной биологии, изучающая структуру и функцию белков, взаимосвязь между ними.
ПРОТЕОМ - совокупность белков клетки или организма. В настоящее время можно составить протеомный портрет человека, существует ПРОТЕОМНАЯ ДАКТИЛОСКОПИЯ.
Развитие ГЕНОМИКИ и ПРОТЕОМИКИ невозможно без компьютерного обеспечения. Компьютеры помогают расшифровать геном, определять структуру белков, моделировать функции и признаки.
БИОДЕКОДОМИКА- раздел молекулярной биологии, занимающийся расшифровкой биологических тестов.
МЕТОДЫ И ПРИНЦИПЫ ГЕНОТЕРАПИИ.
ГЕНОТЕРАПИЯ - введение конструкции в организм человека с лечебной целью.
ГЕНОТЕРАПИЯ подразделяется на:
1. ГЕНОТЕРАПИЯ ex vivo, т.е. коррекция генов в клетках, выведенных за пределы организма, коррекция и возвращение клеток в организм. Появилась в 1986г. - впервые был вылечен иммунодефицит, что необходимо повторять 2 - 3 года, т.е. временные ограничения.
2. ГЕНОТЕРАПИЯ in vivo - системная генотерапия с заменой или введением вновь
нормального гена во все клетки организма. Сложна и пока менее используется.
3. ГЕНОТЕРАПИЯ in situ - генетическую конструкцию вводят в зону патологического
процесса. Например, блокаторы онкогенов вводят в место локализации опухоли после её
удаления.
ГЕНОТЕРАПИЯ может быть фетальная (в настоящее время запрещена) и соматическая.
Способы доставки генов. Частицы, доставляющие фрагмент ДНК, называются векторами.
1. Вирусные - вирусные частицы, лишённые возможности вызывать заболевание, но сохраняют способность проникать в геном клетки и встраиваться в него. В них искусственно вводится нужный ген.
2. невирусные:
белковые - белок как доставляющая частица;
наначастицы - мельчайшие капсулы, представленные фосфолипидами, содержащие в
себе ген. Виды терапевтического переноса генов:
ИНТРО- или ЭКСТРОХРОМОСОМНАЯ КОРРЕКЦИЯ (за пределами хромосом),
Введение системы, продуцирующей нормальный белок взамен патологического - генно-
клеточная патология.
3. Блокада аномальных генов - обеспечивается комплиментарной последовательностью ДНК.
На 2001г. в мире было 3500 пациентов, получающих ГЕНОТЕРАПИЮ, более 2000 из них по
поводу раковых заболеваний. В мире утверждено 320 клинических протоколов ГЕНОТЕРАПИИ.
Перспективы: переход от генной к генно-клеточной терапии.
Лекция № 22. Матричные биосинтезы (окончание).
1.ВИДЫ ГЕННЫХ МУТАЦИЙ.
2.БИОХИМИЧЕСКИЙ ПОЛИМОРФИЗМ И ЕГО ПОСЛЕДСТВИЯ.
3.ОБРАТНАЯ ТРАНСКРИПЦИЯ. ВЛИЯНИЕ АНТИБИОТИКОВ И ТОКСИНОВ НА
4.БИОСИНТЕЗ БЕЛКА.
5.ТЕЛОМЕРЫ И ТЕЛОМЕРАЗЫ. ИХ РОЛЬ В РАЗВИТИИ ОПУХОЛЕВОГО РОСТА.
ВИДЫ ГЕННЫХ МУТАЦИЙ.
ДЕПУРИНИЗАЦИЯ - потеря или замена пуриновых оснований. За 70 лет теряется до 40%. С меньшей скоростью происходит ДЕЗАМИНИРОВАНИЕ и ДЕПИРИМИДИРОВАНИЕ. Белок Р-53 метит повреждённый участок ДНК. Если он работает, то включаются механизмы репарации. Если этого белка нет, то наступают мутации - нерепарированные изменения первичной структуры ДНК. Генные мутации затрагивают небольшой участок ДНК в пределах гена. Виды генных мутаций:
1. замена:
а) одного нуклеотида на другой без изменения смысла кода
ААГ® ААА (ЛИЗИН)
КВАЗИДУПЛЕТНОСТЬ - смысловую нагрузку несут в коде только два нуклеотида
б) замена одного нуклеотида на другой с изменением смысла кодона - МИССЕНС-МУТАЦИЯ
в) замена с образованием терминирующего кодона- НОНСЕНС-МУТАЦИЯ.
2. вставка:
а) вставка одного или нескольких кодонов без сдвига рамки считывания. В результате
образуется белок, удлинённый на одну или несколько аминокислот.
б) вставка 1, 2 (но не кратного 3) нуклеотидов. Происходит сдвиг рамки считывания. В
результате синтезируется белок со случайной аминокислотной последовательностью.
3. ДЕЛЕЦИЯ (выпадение):
а) выпадение одного или нескольких кодонов без сдвига рамки считывания. Образуется полипетид, укороченный на одну или несколько аминокислот.
б) выпадение одного или нескольких (но не кратное 3) нуклеотидов со сдвигом рамки считывания. Образуется ПОЛИПЕПТИД со случайной последовательностью аминокислот. По биологическим последствиям все мутации делятся на:
1. Нейтральные. В результате образуются белки с неизменёнными свойствами. Может произойти замена одной аминокислоты на другую, эквивалентную по свойствам (ВАЛ — АЛА, АСП — ГЛУ). Последствия не проявляются.
2. «Молчащие». В результате одна аминокислота заменяется на другую близкую по свойствам, но не эквивалентную. Свойства белка близки, но не совсем идентичные. Эта мутация в физиологических условиях может никак не проявиться, а в экстремальной ситуации может выявиться (обуславливает предрасположенность к заболеваниям)
3. Патогенные. Например, в гемоглобине А ГЛУТАМИНОВАЯ кислота даёт дополнительный отрицательный заряд, что способствует устойчивости белка в растворе. При замене её на ВАЛ устойчивость утрачивается и гемоглобин выпадает в осадок.
4. Полезные. Организм получает преимущества для выживания. Играют роль в эволюции
организмов.
БИОХИМИЧЕСКИЙ ПОЛИМОРФИЗМ И ЕГО ПОСЛЕДСТВИЯ.
В результате мутаций могут возникнуть варианты разных генов или одного и того же гена. Если они летальные, то наступает АПОПТОЗ. Если эти варианты не летальные, то они наследуются. Формируется генотипическая гетерогенность, следовательно, фенотипическая неоднородность.
Следствием генотипической гетерогенности является ПОЛИМОРФИЗМ белков -существование одного и того же белка в разных формах. Например, насчитывается около 700 вариантов гемоглобина. Каждый человек неповторим, биохимически уникален.
ПОСЛЕДСТВИЯ БИОХИМИЧЕСКОГО ПОЛИМОРФИЗМА.
1. Лежит в основе развития предрасположенности к заболеваниям (атеросклероз)
2. Лежит в основе непереносимости пищевых компонентов (лактозы)
3. Лежит в основе непереносимости лекарственных средств. ВЛИЯНИЕ АНТИБИОТИКОВ И ТОКИНОВ НА БИОСИНТЕЗ БЕЛКА.
Антибиотики - продукты жизнедеятельности микроорганизмов, образуемые с целью гибели других микроорганизмов. Антибиотики поражают самые важные процессы - матричные биосинтезы.
1. Вызывают структурную модификацию матрицы.
2. Вызывают модификацию РИБОСОМ.
3. Инактивируют ферменты.
4. Действуют на процессы биосинтеза белка у микроорганизмов, обычно на этапе трансляции. СТРЕПТОМИЦИН нарушает инициацию трансляции. КИРРОМИЦИН препятствует высвобождению ФЭ трансляции. ЭРИТРОМИЦИН и ХЛОРАМФЕНИКОЛ ингибируют ПЕПТИДИЛТРАНСФЕРАЗУ.
Антибиотики на процессы трансляции у эукариот не влияют.
Токсины - вещества, действующие на процессы трансляции у эукариот.
Дифтерийный токсин ингибирует ФЭ и ТРАНСЛОКАЦИЮ. РИЦИН ингибирует большую единицу РИБОСОМ.
ОБРАТНАЯ ТРАНСКРИПЦИЯ. УОТСОН и КРИК считали, что информация может идти только в одном направлении: ДНК
®РНК®белок.
В 1970г. американский учёный ТЕМЕН открыл ревертазу (ОБРАТНУЮ ТРАНСКРИПТАЗУ), обосновав возможность передачи информации в обратном направлении. Сейчас этот фермент называется РНК-зависимой ДНК-полимеразой. Он имеется у всех РНК содержащих вирусов (лейкоз мышей, ВИЧ).
Интеграция - внедрение вирусной ДНК в ДНК хозяина. При репликации последней образуется РНК вируса. Она покрывается оболочкой, выходит из клетки хозяина и начинает поражать другие клетки.
Многие вирусы являются ОНКОГЕННЫМИ. Они живут в ДНК человека. Онкогены несут информацию о белках опухолевого роста. Они определённое время неактивны -ПРОТООНКОГЕНЫ.
ТЕЛОМЕРЫ И ТЕЛОМЕРАЗЫ. ИХ РОЛЬ В РАЗВИТИИ ОПУХОЛЕВОГО РОСТА.
ТЕЛОМ ЕРЫ - это специализированные кольцевые районы хромосомной ДНК, состоящие из многократно повторяющихся НУКЛЕОТИДНЫХ последовательностей. При каждой репликации их количество уменьшается.
ТЕЛОМЕРАЗЫ - ферменты, синтезирующие теломеры. По свойствам представляют РНК -зависимую ДНК-полимеразу. В своей структуре содержат участок РНК, по которому синтезируется ДНК.
Количество теломер определяет длительность жизни. Если теломераза активна, то клетка бессмертна.
В 1960г. Л. ХЕЙФЛИК открыл феномен - лимит ХЕЙФЛИКА, который заключается в том, что клетка делится ограниченное количество раз, и оно зависит от возраста. У новорожденных клетка делится 80 - 90 раз, в 70лет 20 -30 раз. В среднем у взрослого человека клетки делятся 50 -60 раз. Это связано с эффектом «КОЦЕВОЙ НЕДОРЕПЛИКАЦИИ». Её существование предложил ОНОВНИКОВ.
При каждом раунде репликации одна нить ДНК укорачивается из-за удаления ПРАЙМЕРА. Если есть ТЕЛОМЕРЫ и ТЕЛОМЕРАЗА, то нить ДНК достраивается, если их нет, то с каждым моментом ДНК становится короче. Все соматические клетки содержат 10000-15000 пар нуклеотидов и отсутствует ТЕЛОМЕРАЗНАЯ активность. Клетки с теломеразной активностью бессмертны. Обнаружено, что в раковых клетках активируется теломераза и постоянно количество теломер. Макрофаги, лейкоциты, половые клетки, стволовые клетки костного мозга содержат теломеразную активность.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ОНКОГЕНЕЗА.
Рак - это болезнь генов. Поражение клеточных структур связано или с потерей, повреждением какого-то гена, активацией какого-то гена, или внесением его извне.
ОНКОГЕНЫ - это часто нормальные гены, функционирующие в эмбриональном периоде, но с возрастом утратившие свою активность. Механизм активации - мутации. В настоящее время насчитывается 100 онкогенов. Открыты и антионкогены. ОНКОГЕНЫ и АНТИОНКОГЕНЫ возникают среди генов, которые кодируют белок - передатчик сигналов. Более 100 мутаций ведёт к развитию опухоли. У 50% опухолей содержится мутация гена белка Р-53, участвующего в процессах репарации ДНК. Его отсутствие приводит к накоплению мутаций.
Лекция № 23. Сигнальные молекулы.
Основные задачи регуляции метаболизма и клеточных функций:
1.внутриклеточное и межклеточное согласование клеточных процессов,
2.исключение «холостых» циклов метаболизма, продукты которых не востребованы,
3.эффективное образование и использование энергии,
4.поддержание гомеостаза,
5.приспособление организма к условиям окружающей среды.
Регуляция метаболизма: внутренняя и внешняя. Внутренняя регуляция - управляющие сигналы образуются и действуют внутри одной и той же клетки (само-регуляция). Внешняя регуляция - управляющие сигналы поступают к клетке из внешней среды. Внутренняя регуляция осуществляется путём изменения активности ферментов активаторами или ингибиторами. Особенно активно при внутренней регуляции работают аллостерические ферменты (ФОСФОРИЛАЗА). Внешняя регуляция обеспечивается специализированными сигнальными молекулами - эндогенные химические соединения, которые в результате взаимодействия с ферментами, обеспечивают внешнее управление биохимическими процессами в клетках-мишенях.
Клетка-мишень - это клетка, имеющая специализированные воспринимающие рецепторы для данного вида сигнальных молекул. Сигнальные молекулы являются лигандами для рецепторов клеток-мишеней.
Характерные особенности сигнальных молекул.
1.малый период жизни (динамичность, оперативность регуляции).
2.высокая биологическая активность (действие развивается при очень низких концентрациях).
3.уникальность, неповторимость действия. Эффекты одного типа сигнальных молекул не могут быть смоделированы другим. Это обеспечивает разнообразие регуляции.
4.наличие эффекта усиления (одна сигнальная молекула может усиливать каскады биохимических реакций).
5.один вид сигнальных молекул может иметь несколько клеток-мишеней.
6.реакция разных клеток-мишеней на одну и ту же сигнальную молекулу отличается (объясняется многообразием рецепторов и их своеобразием).
Способы внешнего управления клетками-мишенями.
1.Управление экспрессией генов (биосинтез белков и ферментов). Это медленный способ регуляции.
2.Управление активностью ранее синтезированных белков:
- управление активностью ферментов, следовательно, изменение биохимических процессов;
- изменение активности функциональных белков, следовательно, прямое изменение функции клеток. Например, влияние сигнальных молекул на ионный канал вызывает деполяризацию мембраны и формирование потенциала действия. Чрезвычайно быстрый эффект.
Виды регуляторных эффектов сигнальных молекул:
1.Эндокринный. Сигнальные молекулы поступают с током крови из желудочно-воротной системы к клеткам-мишеням. Так действует большинство гормонов.
2.Паракринный - сигнальные молекулы вырабатывают в пределах одного органа или участка ткани. Таким образом действуют большинство факторов роста.
3.Аутокринное - сигнальные молекулы действуют на клетку, их образовавшую.
КЛАССИФИКАЦИЯ СИГНАЛЬНЫХ МОЛЕКУЛ.
1)По химической природе:
1.Органические (производные аминокислот, жиров). СТЕРОИДЫ, ПРОСТОГЛАНДИНЫ.
2.Неорганические - 1992г. МОНООКСИДАЗОТА (NO).
2)По физико-химическим свойствам:
1.Липофобные - не могут проникать через мембрану клетки. Они растворимы в воде.
2.Липофильные - растворяются в жирах. Свободно проникают через ЦПМ и действуют на рецепторы внутри клетки. Например, производные холестерина: МИНЕРАЛО-, ГЛЮКОКОРТИКОИДЫ, ЭСТРОГЕНЫ, АНДРОГЕНЫ, ЙОДТИРОНИНЫ, NO.
3)По биологическому принципу:
1.Гормоны - сигнальные молекулы с выраженным эндокринным эффектом.
2.Цитокины - факторы роста. Это сигнальные молекулы белковой природы, которые выделяются неспециализированными клетками организма. Они регулируют рост, дифференцировку, пролиферацию соседних клеток. Действие пара- и аутокринно.
3.Нейромедиаторы сигнальные молекулы, вырабатывающиеся нервными клетками, координирующие работу нейронов и управление периферическими тканями. Их действие связано с влиянием на ионные каналы. Они изменяют их проницаемость и вызывают деполяризацию мембраны.
МЕХАНИЗМ ДЕЙСТВИЯ СИГНАЛЬНЫХ МОЛЕКУЛ.
Механизм действия ОРГАНИЧЕСКИХ ЛИПОФИЛЬНЫХ сигнальных молекул.
1.взаимодействие с внутриклеточными рецепторами,
2.регуляторный эффект связан с изменением количества белков в результате влияния на экспрессию генов (действуют через геном),
3. биологическое действие продолжительное, но развивается медленно в пределах часов.
Факторы, необходимые для их действия:
- сигнальные молекулы,
- воспринимающий внутриклеточный рецептор, связанный с шапероном.
- участок ДНК, регулирующий транскрипцию определённых генов (ЭНХАНСЕР, САЙЛЕНСЕР),
- белок синтетический аппарат клетки.
Этапы действия:
1. проникновение внутрь клетки,
2. связывание с внутриклеточным рецептором,
3. освобождение шаперона (запуск таймера действия),
4. взаимодействие комплекса сигнальных молекул с регуляторными элементами ДНК, изменение биосинтеза некоторых белков, в том числе и их ферментов.
5. изменение метаболизма и клеточных функций.
Механизм прекращения действия органических липофильных сигнальных молекул:
1. разрушение рецепторов, обусловленное отсутствие защиты со стороны шаперона,
2. протеолиз синтезированных белков,
3. разрушение факторов транскрипции, участвующих в передаче сигналов к структурному гену.
По перечисленному механизму действуют СТЕРОИДНЫЕ гормоны и ЙОДТИРОНИН.
Механизм действия ЛИПОФОБНЫХ сигнальных молекул:
1. взаимодействие с поверхностными рецепторами,
2. сигнал передаётся от рецептора внутрь клетки (ТРАНСДУКЦИЯ) и устанавливается с помощью внутриклеточных регуляторов: высоко- и низкомолекулярных.
Высокомолекулярные регуляторы - это регуляторные белки. Они опосредуют действие сигнальной молекулы внутри клетки.
Низкомолекулярные регуляторы небелковой природы. Его называют второй МЕССЕНДЖЕР (первый МЕССЕНДЖЕР - сама сигнальная молекула) - полноправный представитель сигнальной молекулы внутри клетки. Это ионы кальция, ДИАЦИЛГЛИЦЕРОЛ, ИНОЗИТОЛТРИФОСФАТ, цАМФ и цГМФ.
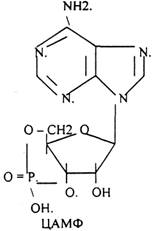
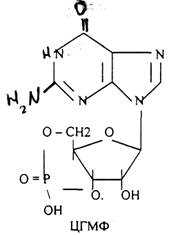
3. биологическое действие обусловлено сочетанием регуляции активности ранее синтезированных белков и регуляция экспрессии генов. Регуляторный эффект двухфазный:
- первая фаза быстрая, но не продолжительная, она обеспечивает изменение структуры и активности ферментов;
- вторая фаза медленная за счёт изменения количества ферментов.
МЕХАНИЗМ ДЕЙСТВИЯ, ЗАВИСИМЫЙ ОТ ЦАМФ.
Факторы, необходимые для этого:
1. растворимая в воде сигнальная молекула;
2. поверхностные рецепторы клетки-мишени;
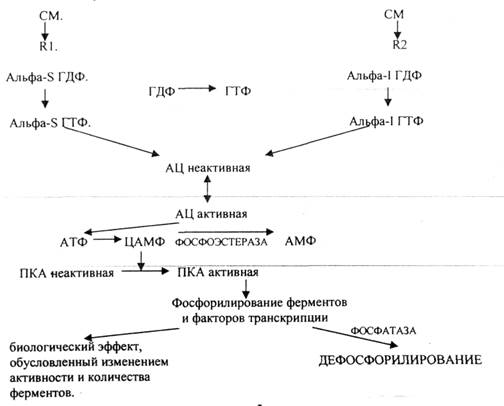
3. внутриклеточный трансдуктор G-белок. Состоит из 3 единиц: альфа, бета, гамма.
G-белок может быть ингибирующий и активирующий. Он находится в непосредственной близости к рецептору. При взаимодействии сигнальной молекулы с рецептором он активируется, его активность обусловлена альфа единицей. Она оказывает влияние на внутриклеточный фермент - АДЕНИЛАТЦИКЛАЗУ (превращает АТФ в ЦАМФ). Альфа-S повышает активность. альфа-I понижает активность G-белка. G-белок способен присоединять ГДФ или ГТФ. Альфа-единица активна, когда связана с ГТФ.
4. АДЕНИЛАТЦИКЛАЗА(АЦ);
5. ПРОТЕИНКИНАЗА-А ЦАМФ-зависимая. Она катализирует реакцию фосфорилирования белков. В результате белки изменяют активность;
6. Регуляторные элементы ДНК (ЭЕХАНСЕР и САЙЛЕНСЕР);
7. ФОСФОДИЭСТЕРАЗА - разрушает ЦАМФ;
8. ФОСФАТАЗА - дефосфорилируют белки;
9. Белок-синтетический аппарат клетки.
Этапы, стимулирующие ЦАМФ -зависимый механизм:
1. взаимодействие сигнальной молекулы с рецептором;
2. изменение конформации G-белка;
3. замена ГДФ на ГТФ в альфа-S единице G-белка;
4. альфа-S ГТФ активирует АЦ;
5. АЦ синтезирует ЦАМФ;
6. ЦАМФ активирует ПРОТЕИНКИНАЗУ-А (ПКА);
7. ПКА фосфорилирует белки и белковые факторы транскрипции, изменяющие активность и количество ферментов;
8. Прекращение действия, если рецептор освободился - альфа-5-С-ГТФ-азная активность:
альфа-единица может разрушать ГТФ - это таймер действия.
- ФОСФОДИЭСТЕРАЗА - разрушает ЦАМФ.
- ФОСФАТАЗА - ДЕФОСФОРИЛИРУЕТ белки. Этапы, ингибируюшие ЦАМФ -зависимый механизм:
С первого по третий те же самые этапы, отличие в G-белке (альфа-I единица). Четвёртый этап - связывание ГТФ с альфа-I единицей будет ингибировать АЦ. Ингибируюший механизм противодействует и прекращает эффекты ЦАМФ в клетке.
ЦГМФ -зависимый стимулирующий механизм действия.
Рецептор встроен в мембрану клетки и связан с ферментом ГУАНИЛАТЦИКЛАЗОЙ (ГЦ). При присоединении сигнальной молекулы ГЦ активируется и катализирует реакцию ГТФ * ЦГМФ. Последний активирует ПРОТЕИНКИНАЗУ-G (ПКО), а она запускает реакцию фосфорилирования белков (ферментов и факторов транскрипции).
ТИРОЗИНКИНАЗНЫЙ МЕХАНИЗМ ДЕЙСТВИЯ.
ТИРОЗИНКИНАЗА - фермент, фосфорилирующий белки. По этому механизму действует большинство факторов роста и пролиферации. Рецептор представлен дуплетом, который после взаимодействия с сигнальной молекулой ДИМЕРАЛИЗУЕТСЯ, что запускает АУТОФОСФОРИЛИРОВАНИЕ остатков тирозина в центральной части рецептора. Наблюдается отсутствие МЕССЕНДЖЕРОВ. Рецептор оказывает влияние на ферментные системы клетки. Он может поступать в ядро вместе с сигнальными молекулами и усиливать транскрипцию генов и изменять митотическую активность клетки.
Механизм действия НЕОРГАНИЧЕСКИХ ЛИПОФОБНЫХ сигнальных молекул (NO). NO беспрепятственно проникает через мембрану клетки. Это короткоживущая молекула, образующаяся в организме под действием NO-СИНТАЗЫ из аминокислоты АРГ. В клетке NO взаимодействует с ГЦ, активирует её, что вызывает накопление в клетке ЦГМФ. который активирует ПКО, и развивается клеточный ответ по выше рассмотренному механизму.
Эффекты NO:
1. фактор расширения сосудов;
2. регулятор АПОПТОЗА (запрограммированной клеточной смерти);
3.NO является свободным радикалом, поэтому способен влиять на процесс перекисного
окисления жиров и регулировать функции МИТОХОНДРИЙ;
4. является ИММУНОМОДУЛЯТОРОМ.
Лекция № 24. Сигнальные молекулы (продолжение).
1.РОЛЬ ГИПОТАЛАМУСА В РЕГУЛЯЦИИ ОБМЕНА ВЕЩЕСТВ.
2.ГОРМОНЫ ГИПОФИЗА.
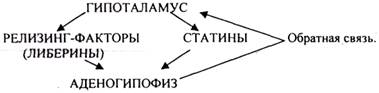
ГИПОТАЛАМУС является компонентом и своеобразным «выходным каналом» лимбической системы. Это отдел промежуточного мозга, контролирующий различные параметры гомеостаза. С одной стороны он связан с ЦНС (центры ВНС), с другой - с гипофизом через нервные проводники и особую портальную систему.
ГИПОТАЛАМУС участвует во многих функциях нервной регуляции, выделяя НЕЙРОТРАНСМИТТЕРЫ и НЕЙРОМОДУЛЯТОРЫ. а также регулирует эндокринную систему. Внешние или внутренние факторы среды
ЦНС
ГИПОТАЛАМУС
АДЕНОГИПОФИЗ
ТРОЙНЫЕ ГОРМОНЫ
ИПОФИЗЗАВИСИМЫЕ
ЖВС ГОРМОНЫ ЖВС
летки-мишени
Физиологический или биохимический ответ.
Функция ГИПОТАЛАМУСА не всегда строго зависима от ЦНС.
| Гормоны ГИПОТАЛАМУСА | Сокращение | Гормоны гипофиза |
| ЛИБЕРИНЫ: КОРТИКОТРОПИНРЕЛИЗИНГ ГОРМОН ТИРЕОТРОПИНРЕЛИЗИНГ ГОРМОН ГОНАДОТРОПИНРЕЛИЗИНГ ГОРМОН ГОРМОН РОСТА РЕЛИЗИНГ ГОРМОН | КРГ ТРГ ГнРГ СтГ-РГ | АКТГ ТТГ ФСГ и ЛГ СТГ |
| СТАТИНЫ: ГОРМОН ИНГИБИРУЮЩИЙ ОСВОБОЖДЕНИЕ ГОРМОНА РОСТА (СОМАТОСТАТИН) ГОРМОН ИНГИБИРУЮЩИЙ ОСВОБОЖДЕНИЕ ПРОЛАКТИНА | СС ПИГ | ГР ПРЛ |
Многие из факторов ГИПОТАЛАМУСА образуются в периферических тканях (ТРГ, КРГ, СС). СС больше всего в D-клетках ПЖЖ. Действуют через ЦАМФ (АДЕНИЛАТЦИКЛАЗУ). Гормоны ГИПОТАЛАМУСА стимулируют транскрипцию генов гормонов гипофиза.
ГИПОФИЗ. В нём выделяют три доли:
1. Передняя
2. Промежуточная
АДЕНОГИПОФИЗ
(выделяет тропные гормоны)
3. Задняя - НЕЙРОГИПОФИЗ.
ТРОПНЫЕ гормоны можно разделить на 3 группы в зависимости от их химической природы:
1. простые белки;
2. ГЛИКОПРОТЕИНЫ;
3. ПЕПТИДЫ, образующиеся из предшественников ПРООПИОМЕЛАНОКОРПИНА (ПОМК).
ПРОСТЫЕ БЕЛКИ.
К ним относятся: ГР, ПРЛ, ПЛАЦЕНТАРНЫЙ ХОРИОНИЧЕСКИЙ СОМАТОМАММОТРОПИН (ХС). Состоят из 191 - 198 аминокислот. ГР близок по строению с ХС на 85%, ПРЛ - на 35%.Среди этих гормонов наибольшую концентрацию имеют ГР. Секреция ГР эпизодическая. Максимальная секреция в момент засыпания или перед пробуждением. На секрецию влияют стресс, голод, физические упражнения. ГР сберегает глюкозу для тканей.
Он повышает ЛИПОЛИЗ, ® повышается концентрация жирных кислот, ® повышает
транспорт в клетку ® повышает концентрацию аминокислот ® повышает
ГЛЮКОНЕОГЕНЕЗ ® повышение глюкозы ® мозг.
ГР действует через инсулиноподобный фактор роста (ИФР), близкий по строению к проинсулину. Выделяют ИФР 1 и ИФР 2, но главным посредником действия ГР является ИФР 1. Влияние ГР на обмен веществ:
1. Стимуляция синтеза белка: (через ИФР I.)_
- повышение транспорта аминокислот в клетки,
- повышение интенсивности процесса трансляции,
- повышение синтеза РНК и ДНК
2. Влияние на углеводный обмен:
- повышение глюкозы (уменьшение утилизации глюкозы периферическими тканями, стимуляция процессов ГЛЮКОНЕОГЕНЕЗА),
3. Влияние на минеральный обмен (через ИФР1) - задержка кальция, фосфора, магния в организме,
4. Влияние на липидный обмен (не через ИФР 1):
повышение ЛИПОЛИЗА, повышение окисления ВЖК.
ГИПОСЕКРЕЦИЯ в детском возрасте приводит к нарушению синтеза белка, понижению минерализации костной ткани, задержке роста и развитию карликовости в нескольких вариантах.
ГИПЕРСЕКРЕЦИЯ гормона роста в детском возрасте приводит к развитию гигантизма, во взрослом развитию акромегалии. Нарушение синтеза гормона роста на умственную деятельность не влияет.
ПРЛ состоит из 198 аминокислот. Синтезируется при беременности и лактации. Функция заключается в инициации и поддержании лактации.
ХС проявляет ЛАКТОГЕННУЮ и МОТЕОТРОПНУЮ активность. Функция заключается в регуляции синтеза молока, развития желтых тел и развития плода.
ГЛИКОПРОТЕИНЫ. К ним относятся ТТГ, гонадотропины (ЛГ, ФСГ, ПЛАЦЕНТАРНЫЙ ХОРИОНИЧЕСКИЙ ГОНАДОТРОПИН (ХГЧ)). Действуют через ЦАМФ.
ФСГ:
Женские клетки-мишени - фолликулярные клетки яичника,
Мужские клетки-мишени - клетки СЕРТОЛИ семенников.
В женском организме стимулирует рост фолликулов, подготавливают их к действию ЛГ. В мужском организме индуцирует синтез АНДРОГЕНСВЯЗЫВАЮЩЕГО белка. Стимулирует рост семенных канальцев семенников и сперматогенез.
Л Г:
Женские клетки-мишени - клетки желтых тел, Мужские клетки-мишени - клетки ЛЕЙДЕГА.
Стимулирует образование в женском организме ПРОГЕСТЕРОНА, а в мужском -ТЕСТОСТЕРОНА. Предшественником их является ХОЛЕСТЕРОЛ. ЛГ индуцирует овуляцию у женщин. ХГЧ синтезируется в плаценте и близок по эффектам к ЛГ. Появляется в моче после имплантации зародыша. Его определение служит диагностическим маркером беременности.
ТТГ: Клетки-мишени - ТИРЕОЦИТЫ.
- Повышает синтез ТРИЙОДТИРОНИНА и ТИРОКСИНА.
- Повышает гидролиз белка - ТИРЕОГЛОБУЛИНА.
- Повышает включение йода в структуру ТИРЕОИДНЫХ гормонов.
- Стимулирует синтез белка и нуклеиновых кислот в щитовидной железе (способствует
- повышению количества и росту ТИРЕОИДНЫХ гормонов)
ПЕПТИДЫ СЕМЕЙСТВА ПОМК.
ПОМК - белок, состоящий из 285 аминокислот. Процессинг его происходит в передней и промежуточной доле гипофиза. Из него образуются пептиды: АКТГ. бета ЛИПОТРОПИН. N-концевой пептид. АКТГ:
1. альфа -МЕЛАНОЦИТСТИМУЛИРУЮЩИЙ гормон (МСГ) (промежуточная доля).
2. КОРТИКОТРОПИНОПОДОБНЫЙ ПЕПТИД. Бета-ЛИПОТРОПИН:
1. бета -ЭНДОРФИНЫ: альфа -ЭНДОРФИНЫ, гамма -ЭНДОРФИНЫ.
2. Альфа-ЛИПОТРОПИН.
3. Бета -МСГ.
N-концевой ПЕПТИД: гамма -МСГ.
АКТГ - полипептид, состоящий из 39 аминокислот. Клетки-мишени - клетки коры надпочечников. Стимулирует синтез стероидов коры надпочечников из холестерина через ЦАМФ.
Повышается АДЕНИЛАТЦИКЛАЗА в жировой ткани.
Усиливается ЛИПОЛИЗ ® ВЖК ® АЦЕТИЛ-КОА ® ХОЛЕСТЕРОЛ
СТЕРОИДНЫЕ ГОРМОНЫ.
АКТГ стимулирует процессы пентозного цикла и является поставщиком НАДН2 Повышает синтез белка и нуклеиновых кислот в надпочечниках. ГИПЕРСЕКРЕЦИЯ проявляется в виде синдрома КУШИНГА:
1. повышение пигментации,
2. отрицательный азотистый баланс, выход азота, калия, фосфора.
3. задержка в организме натрия (отёки, повышение АД).
Бета -ЛИПОТРОПИН усиливает липолиз.
Бета -ЭНДОРФИНЫ в гипофизе связаны и неактивны. В гипоталамусе и ЦНС они переходят в активную форму и играют роль нейромедиаторов, трансмиттеров. Понижают чувствительность к боли. Играют важную роль в эмоциональных состояниях. МСГ стимулирует образование меланина.
ГОРМОНЫ ЗАДНЕЙ ДОЛИ ГИПОФИЗА.
1. Вазопрессин (АДГ).
2. Окситоцин.
Образуются в ядрах гипоталамуса. Являются циклическими НАНАПЕПТИДАМИ (9
аминокислот)
АДГ: клетки-мишени - клетки кровяных сосудов, дистальных извитых канальцев и
собирательных трубочек почек. Повышают реабсорбцию воды в почках. Действует через ЦАМФ.
ГИПОСЕКРЕЦИЯ - несахарный диабет.
ОКСИТОЦИН: клетки-мишени - главные миоциты матки, клетки молочных желез. Повышает
сокращение матки и секрецию молока. Используется для стимуляции родовой деятельности.
|
|