
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Понятие о стандартном электродном потенциале
|
|
Для того, чтобы сравнивать значения потенциалов различных электродов необходимо работать в стандартных условиях, т.е. при температуре 25 0С (298, 15 К), давлении 101, 325 кПа (1 атм) и активности ионов 1 моль/л.
Потенциал любого электрода, измеренный относительно стандартного водородного электрода в условиях, когда активности окисленной и восстановленной форм равны называется стандартным электродным потенциалом данного электрода (Е0).
Электродный потенциал водородного электрода зависит от концентрации ионов H+ в растворе и давления водорода в газовой фазе. Стандартный электродный потенциал водородного электрода измеряют активности H+ = 1 и рН2= 1 атм.
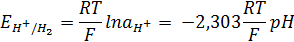
При T = 298 K:
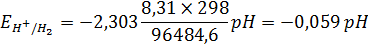
Стандартный потенциал стандартного водородного электрода условно принимают равным нулю.
Стандартные электродные потенциалы относятся к определенному электродному процессу. Стандартные потенциалы некоторых электродных процессов представлены в таблице…….
Таблица… Стандартные потенциалы пар Mn+/M0
(составлено по: Химия, 2000)
| Катион/металл | Е0, В | Катион/металл | Е0, В |
| K+/K | -2, 924 | Fe2+/Fe | -0, 441 |
| Ca2+/Ca | -2, 864 | Fe3+/Fe | -0, 037 |
| Na+/Na | -2, 711 | H+/H2 | ± 0, 000 |
| Mg2+/Mg | -2, 370 | Cu2+/Cu | +0, 338 |
| Mn2+/Mn | -1, 192 | Cu+/Cu | +0, 518 |
| Zn2+/Zn | -0, 763 | Hg2+/Hg | +0, 852 |
Стандартный потенциал пары Mn+/M0 имеет положительный знак, если металлический электрод заряжается положительно, относительно водородного электрода. Если металлический электрод заряжается отрицательно относительно водородного электрода, стандартный потенциал пары Mn+/M0 имеет отрицательный знак.
На практике стандартный водородный электрод использовать неудобно, так как необходимо использовать чистый газ Н2 и подавать его с постоянным давлением. Кроме того, в процессе эксплуатации электрода, каталитическая активность платины снижается, что влияет на воспроизводимость и стабильность работы электрода.
Очень часто в качестве электродов сравнения используют каломельный или хлорсеребряный электроды, потенциал которых определяется активностью ионов хлора (таблица…).
Таблица…. Электродные потенциалы каломельного и хлорсеребряного электродов сравнения при 25 0С (Горшков, Кузнецов, 1986)
| Концентрация KCl, моль/л | Электродный потенциал, В | |
| Каломельный электрод | Хлорсеребряный электрод | |
| 0, 1 | +0, 3358 | +0, 290 |
| 1, 0 | +0, 2810 | +0, 238 |
| ≈ 3, 5 (насыщенный) | +0, 2420 | +0, 201 |
4. Определение стандартного значения ЭДС (Е0) окислительно-восстановительной реакции
Стандартное значение ЭДС (Е0) окислительно-восстановительной реакции можно определить исходя из понятий «ЭДС электрохимической цепи» и «стандартный электродный потенциал».
Для окислительно-восстановительной реакции
Ox1 + Red2 = Red1 + Ox2
стандартное значение ЭДС (Е0) будет равно разности стандартных электродных потенциалов:
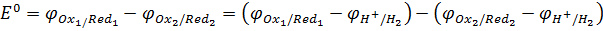
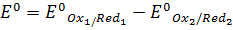
Таким образом, Е реакции (иногда обозначают как Δ E) – это разность E полуреакции восстановления, записанной в прямом направлении и E полуреакции восстановления записанной в обратном направлении (Морозов и др., 2003).
|
|