
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Органическая химия
|
|
Задача 1 (автор Трушков И. В.)
1. Если соединение D содержит один атом азота, МD = 14/0, 378 = 37. Соединение с такой молекулярной массой образоваться не может. Если D содержит два атом азота, МD = 74. Этой массе отвечает соединение состава С2Н6N2O. Тогда мы можем написать, что происходило в колбах.
Колба С.
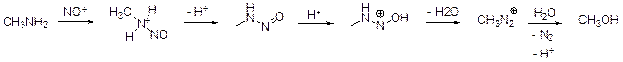
Уравнение реакции: CH3NH2 + NaNO2 + HCl = CH3OH + N2 + NaCl + H2O
Поскольку продуктами реакции являются метанол и вода, в водно-метанольном растворе их обнаружить невозможно. А присутствие ионов Na+ и Cl– не говорит о том, что прошла какая-то реакция, т. к. эти ионы находились в добавленных растворах.
Колба В. Реакция останавливается на стадии образования N -нитрозопроизводного D.
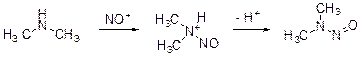
Уравнение реакции: (CH3)2NH + NaNO2 + HCl = (CH3)2NNO + NaCl + H2O
Колба А Третичные амины не реагируют с катионом нитрозония. (Его взаимодействие с неподеленной парой электронов на атоме азота амина является обратимым процессом). Однако со временем часть такого катиона отщепляет HNO. В результате получается иминиевая соль, которая гидролизуется в условиях реакции с образованием диметиламина и формальдегида (Е). Диметиламин далее превращается в D так, как это происходит в колбе B.
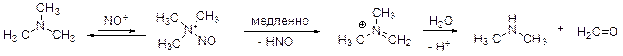
Уравнение реакции:
(CH3)3N + 2NaNO2 + 2HCl = (CH3)2NNO + CH2O + 2NaCl + HNO + H2O
2. Этиловый эфир глицина содержит 4 атома углерода. Если все эти атомы присутствуют в продукте, то М F = 48/0, 421 = 114. При этом в молекуле присутствуют также 2 атома кислорода и не менее 5 атомов водорода. На остальные атомы остается 29 а. е. м. Единственный вариант – два атома азота и один атом водорода, т. е. продуктом является диазоуксусный эфир, N2CHCO2C2H5.
3. Анилин реагирует качественно аналогично метиламину, однако образующаяся соль диазония относительно устойчива ввиду высокой нестабильности фенильного катиона, который должен образоваться из нее в ходе реакции SN1. Таким образом, G – PhN2+Cl–. Со временем эта соль все же распадается, при этом в качестве нуклеофилов, взаимодействующих с фенильным катионом, могут выступать как вода, так и метанол. Продуктами будут, соответственно, фенол H, умеренно растворимый в водном метаноле и хорошо растворимый в присутствии щелочи, и анизол (PhOMe) I. Содержание углерода в I равно 77, 8%. Тогда содержание углерода в J будет либо 63, 5%, либо 92, 3%. Второй вариант согласуется с углеводородом состава (СН)n. Очевидно, в данном случае это – бензол. Поскольку J образуется в эквимолярных количествах с Е (т. е. с формальдегидом), этот результат можно объяснить переносом гидрид-иона от спирта к фенильному катиону. Такой процесс восстановления солей диазония эффективно протекает с изопропиловым спиртом, умеренно – с этиловым спиртом и в небольшом количестве – со спиртом метиловым.
4. При добавлении щелочи к соли диазония сначала происходит образование ковалентно-связанного продукта Ph–N=N–OH, который легко депротонируется с образованием Ph–N=N–O–Na+. Это – соединение К. При подкислении оно превращается обратно в соль диазония. При добавлении к соли диазония анилина первичная атака происходит по атому азота анилина. Продуктом реакции является триазин PhNH–N=N–Ph (L), который можно выделить и хранить и который при подкислении снова образует соль диазония. С другой стороны, анилин может реагировать с солью диазония по реакции азосочетания с образованием продуктов электрофильного ароматического замещения в пара - или орто -положение. Вследствие стерических затруднений атака протекает в основном в пара -положение. Таким образом,
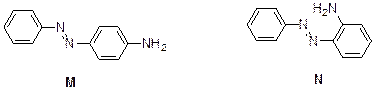
5. Первичный продукт реакции – N -нитрозо- N -метиланилин. При нагревании он перегруппировывается в 4-нитрозо- N -метиланилин, о чем свидетельствует характеристичный сигнал ароматических протонов в виде дублета дублетов.
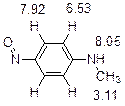
Система оценивания:
1. Объяснение процессов, протекающих в каждой колбе и уравнения реакций: 3´ 2 балла. Всего 6 баллов.
2. 2 балла
3. 4 структуры по 1.5 балла. Всего 6 баллов.
4. 4 структуры по 2 балла. Всего 8 баллов.
5. 3 балла (2 за структуры, 1 за отнесение)
Итого 25 баллов
Задача 2 (авторы Карлов Д. С., Трушков И. В.)
1. Даже по названию «циангидрин» можно догадаться, что А содержит цианогруппу и гидроксигруппу. Это соединение образуется в результате присоединения цианид-иона к несущему частичный положительный заряд карбонильному атому углерода с последующим протонированием атома кислорода. Гидролиз цианогруппы приводит к образованию молочной кислоты, CH3CH(OH)COOH. Нагревание А с оксидом алюминия приводит к отщеплению воды с образованием акрилонитрила В, CH2=CHCN. Полимеризация В дает широкоизвестный полимер полиакрилонитрил (ПАН).
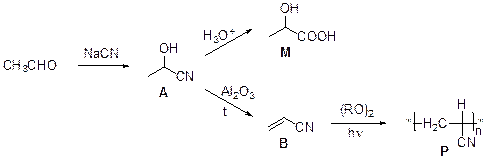
2. По элементному составу С можно определить его молекулярную формулу как (С7Н6О)n, что соответствует формуле бензальдегида. В реакции С с гидридом натрия выделяется водород вследствие наличия в С одного или нескольких атомов водорода, проявляющих достаточно высокую кислотность. Таких атомов в бензальдегиде нет. Если в С такой атом один, М С = 232. Тогда формула С – С14Н12О2. Если таких атомов два, М С = 464 и т. д. Образование из С бензальдегида при действии периодата натрия говорит о том, что С образован фрагментами типа С6H5–CH(OH)–CH(OH)–С6H5 и аналогами, где группа СН(ОН) заменена на С=О. Таким образом, С имеет формулу С6H5–C(O)–CH(OH)–С6H5. Это соединение имеет тривиальное название бензоин, а саму реакцию называют бензоиновой конденсацией.
3. Молекулярная масса D равна 29, 666n, где n – число атомов углерода. Отсюда значение n должно быть кратно трем. Наиболее логично предположить, что структура D аналогична структуре циангидрина (т. е. n = 3, M D = 89), но вместо гидроксигруппы присутствует аминогруппа. Иначе говоря, D – 2-аминопропановая кислота, или аланин (одна из важнейших аминокислот). В сильнокислой среде аланин существует в полностью протонированной форме; в сильнощелочной – в депротонированной; в нейтральной – в цвиттер-ионной.
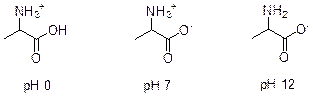
4. Первая стадия – бромирование бензола с образованием PhBr (Е). При взаимодействии Е с магнием образуется соответствующий реактив Гриньяра PhMgBr (F), реакция которого с этиленоксидом с последующей нейтрализацией дает фенэтиловый спирт G, PhCH2CH2OH. Окисление спирта дает фенилуксусный альдегид H (PhCH2CHO). Хорошо известно, что Бранд выделил из сухого остатка мочи фосфор при его прокаливании с белым песком. Впрочем, правильный ответ о соединении I можно получить, не зная этого, а используя только данные по содержанию галогена. Единственный ответ при наличии этих данных – PCl3. При взаимодействии PCl3 с этанолом теоретически возможны две реакции: 1) образование этилхлорида и фосфористой кислоты или ее хлорангидридов; 2) образование HCl и этилового эфира фосфористой кислоты. Первый вариант не согласуется с данными по содержанию Y в соединении J. Во втором случае условие выполняется, если J – диэтиловый эфир фосфористой кислоты, [HOP(OC2H5)2], таутомерной формой которого является [HP(O)(OC2H5)2]. Реакция между бензиламином, фенилуксусным альдегидом Н и диэтилфосфитом J аналогична реакции Штрекера. Она была открыта в середине 20 века М. Кабачником и, независимо от него, Э. Филдсом и носит их имена. При этом два реагента (альдегид и амин) те же, что и в реакции Штрекера, а вместо цианид иона используется диэтилфосфит. Образование циангидрина идет в результате присоединения цианид-иона к альдегиду (кетону), образование аминонитрила в реакции Штрекера можно рассматривать как присоединение цианид-иона к имину, образующемуся из альдегида и амина с отщеплением воды). Соединение К также образуется с отщеплением молекулы воды; следовательно, продукт образуется в результате присоединения диэтилфосфита к имину аналогично присоединению к имину HCN. Так как в условии сказано, что Х содержит связь углерод–фосфор, понятно, что атака J на имин идет именно атомом фосфора. Из содержания фосфора следует, что М К = 347, т. е. единственным побочным продуктом является молекула воды. При этом М Х = 201. Можно предположить, что на последней стадии происходит гидролиз эфира фосфоновой кислоты (потеря массы равна 2´ М(С2Н4) = 56 а.е. м.). Тогда на предыдущей стадии происходит потеря массы, равная 90 а. е. м. Это соответствует фрагменту С7Н6, т. е. замене бензильной группы на атом водорода. Это – результат гидрогенолиза связи Bn–N. Итак,
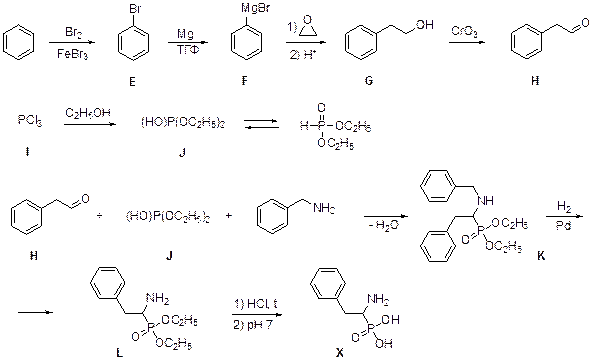
5. Например, аденозинмонофосфат или другие нуклеотиды.

Система оценивания:
1. 3 структуры по 2 балла. Мономерное звено – 1 балл. Всего 7 баллов.
2. 2 балла
3. 3 структуры по 1 баллу. Всего 3 балла.
4. Структуры Е–J по 1 баллу. Структуры K, L, X по 2 балла. Всего 12 баллов.
5. 1 балл
Итого: 25 баллов
Задача 3 (авторы Беркович А. К., Карпушкин Е.)
1. Натуральный каучук представляет из себя полимер изопрена (2-метилбутадиена), поперечные сшивки в его структуре практически отсутствуют, а мономерные звенья соединены между собой 1, 4- цис -связями:
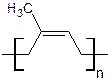
2. При вулканизации бутадиенстирольного каучука на первой стадии происходит распад молекулы пероксида на 2 радикала:
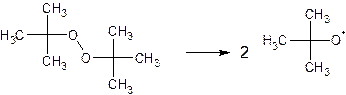
Образовавшийся радикал атакует полимерную молекулу, отрывая водородный атом в a-положении к двойной связи с образованием макрорадикала (символом R обозначены фрагменты полимерной цепи, не участвующие в реакции):

Макрорадикал, в свою очередь, атакует двойную связь в соседней молекуле с образованием поперечной сшивки.

Далее процесс продолжается по цепному механизму, аналогичному радикальной полимеризации.
3. Исходя из названия класса полимера, логично предположить, что его основная цепь построена из фрагментов –Si–O–. Тогда брутто-формулу можно переписать как (SiO(OCH3)2)n, а структура полимера выглядит так:

4. Клеточные стенки растений в основном построены из целлюлозы. Этот полимер относится к классу простых полиэфиров.
5. При повышении pH слабая полиакриловая кислота переходит в солевую форму – полиакрилат натрия. Гидратация даже контактной ионной пары (карбоксилат-натрий) существенно выше, чем у недиссоциированной карбоксильной группы, при образовании сольватно-разделенной ионной пары гидратация возрастает еще сильнее, а вместе с ней и максимальная сорбционная способность. Поэтому при повышении pH от 2–3 до 9–10 сорбционная способность материалов на основе полиакриловой кислоты увеличивается. В сильнощелочной среде сорбционная способность несколько снижается, так как ионы натрия конденсируются на цепях полиэлектролита, и доля контактных ионных пар растет, но практического значения в гигиенических приложениях этот эффект не имеет.
6. Одна из возможных схем расчета: в сутки с пищей и питьем ребенок получает 3·0, 8 = 2, 4 кг воды, причем 2, 4·0, 1 = 0, 24 кг воды выделяется при дыхании. Итого 2, 16 кг воды должно быть поглощено памперсами, то есть каждый подгузник должен поглощать 0, 54 кг воды. Тогда масса сухого сорбента в каждом подгузнике должна составлять минимум 0, 54/15 = 0, 036 кг или 36 г. После поглощения жидкости масса сорбента составит 0, 54+0, 036 = 0, 576 кг, а его влажность будет равна 0, 54/0, 576 = 93, 75%.
7. Наличие в смеси азота указывает на то, что использовались соли аммония. Выделение углекислого газа ограничивает выбор парой карбонат аммония – гидрокарбонат аммония. Пусть мольная доля карбоната равна x, тогда массовая доля азота в смеси равна (14, 0067·2· x +14, 0067·(1 – x))/(96, 09 x + 79, 06(1 – x)) = 0, 220, откуда x = 0, 330, значит, карбонат и гидрокарбонат аммония находились в смеси в мольном соотношении 1: 2. При разложении такой смеси солей образуется смесь аммиака, воды и углекислого газа в молярном соотношении 4: 3: 3. Средняя молярная масса такой смеси составляет 25, 42 г/моль. Тогда из уравнения Менделеева-Клапейрона можно рассчитать массу газа. pV = mRT / M, то есть m = pVM / RT. Подставляя известные числовые данные, получим, что масса газов равна 3, 67 г. При объеме мячика в 1, 766 л плотность газовой смеси составит 2, 08 г/л. (Эту же величину можно рассчитать иначе, приведя к давлению 2 атм плотность газовой смеси заданного состава)
8. Полиэтиленовые пакеты практически никогда не прокрашиваются в массе, потому что это приводит к неоправданному расходу красителя. Исключения – пакеты для мусора, в которые добавляется недорогой пигмент (сажа) и специальные упаковки для компьютерных деталей, в которые проводящая добавка (например, графит) вводится для снятия статического электричества и предотвращения порчи микросхем. Красители, наносимые на поверхность полиэтилена, представляют собой, как правило, сильно полярные молекулы, и такие вещества слабо удерживаются на неполярном материале полиэтилена. С целью повышения полярности поверхности и производится обработка полиэтилена кислотами-окислителями, в ходе которой могут происходить различные процессы, основными из которых являются окисление атомов углерода основной цепи до спиртовых или кетонных фрагментов, а также окисление боковых цепей с разрывом C–C связей и образованием карбоксильных групп:

Система оценивания:
1. 1 балл
2. 3 балла за 3 схемы реакций.
3. 1 балл
4. 2 ответа по 1 баллу. Всего 2 балла.
5. 2 балла за увеличение сорбционной способности при защелачивании при наличии аргументации.
6. Максимум 4 балла.
7. 2 балла за определение солей + 2 балла за расчет соотношения + 5 баллов за расчет массы и плотности. Всего 9 баллов.
8. 1 балл за объяснение, по 1 баллу за каждое из направлений. Всего 3 балла
Итого 25 балов
|
|