
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Определение основных свойств наружной и внутренней среды
|
|
Для расчетов количеств вредных веществ, выделяющихся из технологического оборудования в атмосферный воздух, необходимо знать основные свойства химических соединений и их смесей.
В Приложении приведены характеристические константы чистых веществ, которые используются для расчета свойств химических соединений и их смесей.
При температуре, отличающейся от 20 оС, плотность жидкости рассчитывается по формуле:
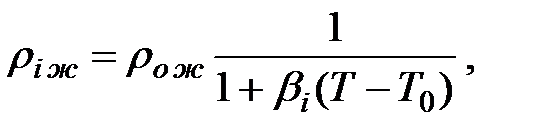 (1.1)
(1.1)
где bi – коэффициент температурного расширения, выражающий относительное увеличение объема жидкости при увеличении температуры на 1 оС.
Коэффициент температурного расширения капельных жидкостей незначителен. Для практических расчетов количеств вредных веществ, выделяющихся из оборудования и трубопроводов для жидкостей можно принять:
r tж = r ож.
Плотность газа или пара при t = 0 оC и Pо = 100 кПа рассчитывают по следующей формуле:
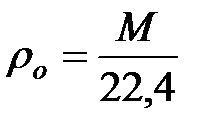 , кг/м3 (1.2)
, кг/м3 (1.2)
где М – относительная молекулярная масса вещества, кг/(кмоль);
22, 4 – объем 1 кмоля газа или пара при НУ, м3.
Для определения плотности газа или пара при температуре 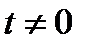 оC и давлении
оC и давлении 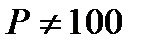 кПа используют уравнение Клапейрона:
кПа используют уравнение Клапейрона:
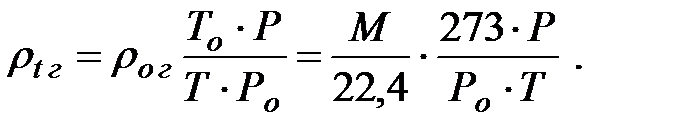 (1.3)
(1.3)
Динамическую вязкость газов и паров при 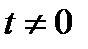 оC рассчитывают по формуле:
оC рассчитывают по формуле:
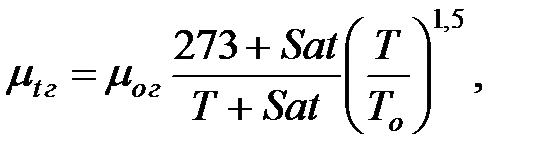 (1.4)
(1.4)
где Sat – константа Сатерленда (Приложение).
В практических расчетах для расчета динамической вязкости жидкости mtж при 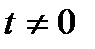 оC при определении количества вредных веществ, выделяющихся через неплотности соединений трубопроводов и оборудования, можно использовать формулу Пуазейля:
оC при определении количества вредных веществ, выделяющихся через неплотности соединений трубопроводов и оборудования, можно использовать формулу Пуазейля:
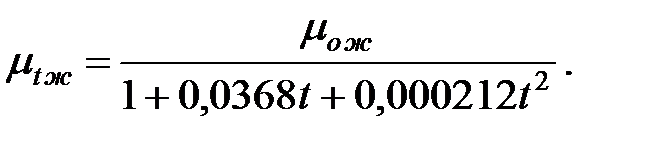 (1.5)
(1.5)
Изменение динамической вязкости с изменением температуры является существенным. Так, с увеличением температуры от 0 до 100 оС вязкость воды уменьшается в 7 раз.
Кинематическая вязкость n (м2/с) связана с динамической вязкостью m соотношением:
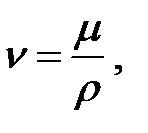 (1.6)
(1.6)
где m - динамическая вязкость, Па·с; r - плотность, кг/м3.
Коэффициент диффузии, который необходим для расчетов количества выделяющихся вредных веществ из оборудования, можно рассчитать по следующей зависимости:
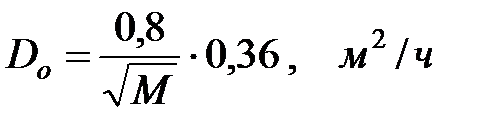 (1.7)
(1.7)
где Dо – коэффициент диффузии при t = 0 оС и Рo = 100 кПа.
Коэффициент диффузии при 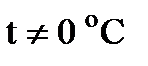 и
и 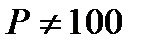 кПа определяют по формуле:
кПа определяют по формуле:
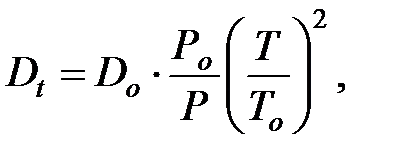 (1.8)
(1.8)
где Ро = 100 кПа; Tо = 273 К;
Р и Т – давление и температура в оборудовании или трубопроводе.
Чтобы найти коэффициент диффузии при любой температуре, используют формулу:
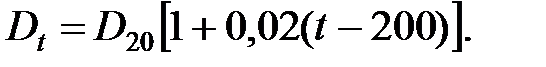 (1.9)
(1.9)
Часто на практике встречаются не чистые вещества, а их смеси. Состав среды в оборудовании или трубопроводе задается в массовых, объемных или мольных долях.
Мольная доля компонента:
 (1.10)
(1.10)
Массовые доли компонентов пересчитывают в мольные - по формуле:
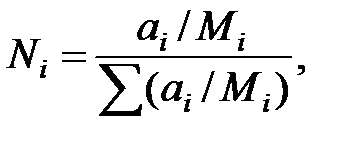 (1.11)
(1.11)
где Ni – мольная доля компонента;
ai – массовая доля компонента;
Мi – молекулярная масса компонента.
Когда в трубопроводе или оборудовании находится смесь жидкостей, плотность этой смеси определяют по выражению:
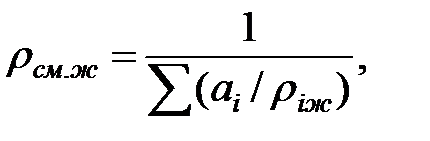 (1.12)
(1.12)
где riж – плотность компонента.
Динамическая вязкость смеси нормальных жидкостей определяется из выражения (Па·с):
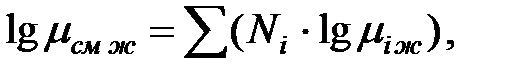 (1.13)
(1.13)
где Ni – мольная доля компонента в смеси;
miж – соответствующий коэффициент динамической вязкости.
Если в трубопроводе или оборудовании находится смесь газов или парогазовоздушная смесь, то вязкость газовых (паровых) смесей можно вычислить по приближенной формуле:
 (1.14)
(1.14)
где Мсм, г, Мi – молекулярные массы смеси газов и отдельных компонентов;
vi – объемные (молярные) доли компонентов в смеси (viг = Niг),
mсм г, mi - коэффициенты динамической вязкости смеси газов и отдельных компонентов.
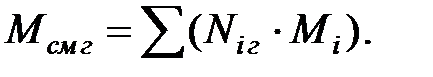 (1.15)
(1.15)
Кинематическая вязкость газовой смеси:
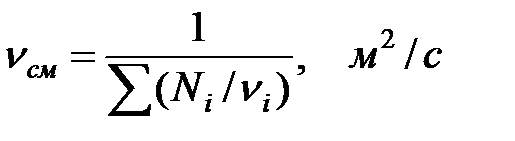 (1.16)
(1.16)
или
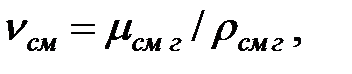 (1.17)
(1.17)
где ni – кинематическая вязкость компонента газовой смеси.
Плотность смеси газов определяется по формуле (кг/м3):
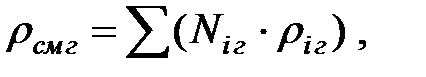 (1.18)
(1.18)
где Ni – мольные доли компонентов газовой смеси;
riг – плотность соответствующих компонентов.
При расчете количеств вредных веществ, выделяющихся со свободной поверхности жидкости, необходимо помнить, что они состоят из смеси веществ, состав которых зависит от температуры, давления, а так же от объемной (мольной) доли каждого вещества в растворе.
Давление газовой смеси над раствором равно:
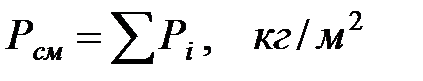 (1.19)
(1.19)
где Рi – парциальное давление компонента смеси.
Согласно закону Рауля парциальное давление компонента, входящего в состав смеси, определяется по формуле:
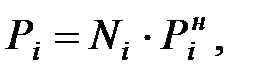 (1.20)
(1.20)
где Ni – мольная доля компонента в растворе;
Рiн – давление насыщенного пара вещества над чистым компонентом при заданной температуре.
Зависимость давления насыщенного пара чистого вещества от температуры описывается уравнением:
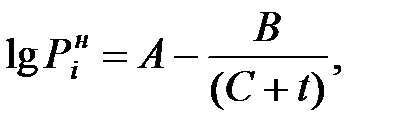 мм рт ст (1.21)
мм рт ст (1.21)
или
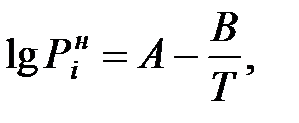 (1.22)
(1.22)
значения эмпирических коэффициентов А, В, С (константы Антуана) для чистых веществ приведены в Приложении.
Парциальное давление насыщенных водяных паров в наружной среде (т.е. в газовой фазе) определяется по формуле:
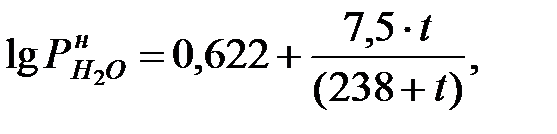 (1.23)
(1.23)
где t – температура наружной среды, оС.
Парциальное давление водяных паров при заданной влажности наружной среды определяется по формуле:
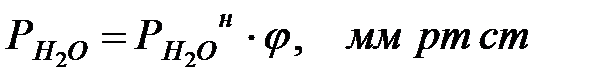 (1.24)
(1.24)
где j - влажность наружной среды, %.
Зная объемный или массовый состав смеси в оборудовании и данные о давлении насыщенных паров веществ, составляющих смесь, можно определить количественный состав газовой смеси над поверхностью жидкости. Концентрацию насыщенных паров компонента, выраженную в единицах давления, можно пересчитать в объемную концентрацию по следующей формуле:
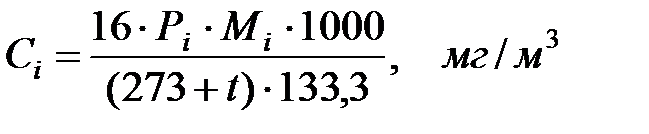 (1.25)
(1.25)
где Рi – парциальное давление компонента газовой смеси при заданной температуре и давлении, Па;
Мi – молекулярная масса данного вещества; 1 мм рт ст = 133, 322 Па.
Пример 1.1. Определить параметры среды в производственном помещении.
Исходные данные: влажность в помещении φ = 60%; концентрация дихлорэтана в воздухе СД =5 мг/м3; температура t = 16 оC; давление среды В = 101, 3 кПа.
Решение. Относительные молекулярные массы составляющих среды:
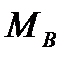 = 28, 96;
= 28, 96; 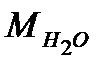 = 18, 015;
= 18, 015; 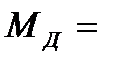 98, 97.
98, 97.
Давление насыщения водяных паров в воздухе производственного помещения:
lg 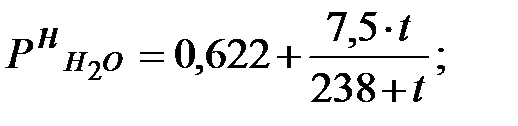
lg 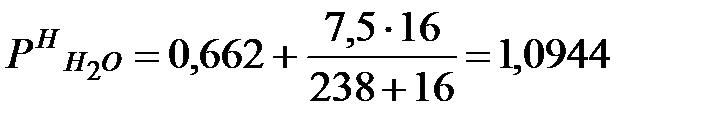
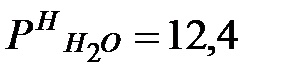 мм рт. ст. или 1653 Па.
мм рт. ст. или 1653 Па.
Давление водяных паров при заданной влажности в помещении:
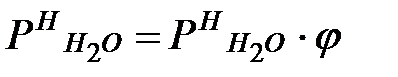
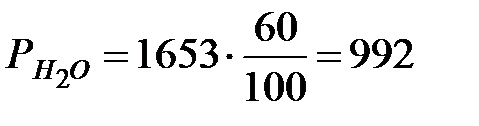 Па.
Па.
Парциальное давление примеси (дихлорэтана):
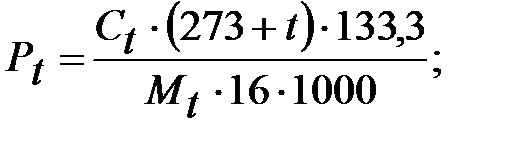
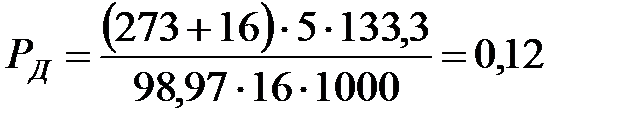 Па.
Па.
Парциальное давление основного компонента наружной среды – воздуха:

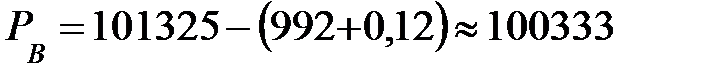 Па.
Па.
Мольные доли составляющих наружную среду:
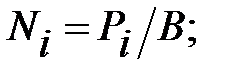
NД = 100333/101325 = 0, 9902; 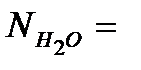 993/101325 = 0, 00979;
993/101325 = 0, 00979;
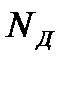 = 0, 12/101325 = 0, 00001
= 0, 12/101325 = 0, 00001
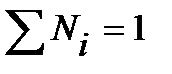
Концентрация составляющих наружной среды, мг/м3:
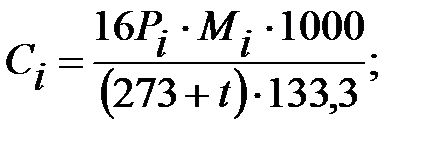
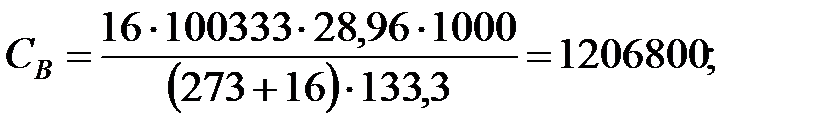
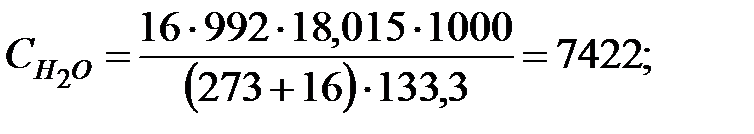
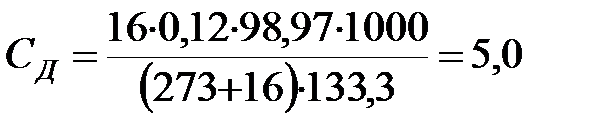 .
.
Произведение NiPi для газовых составляющих наружной среды, мг/м3 (кг/м3):
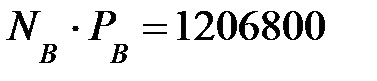 (1, 207);
(1, 207);
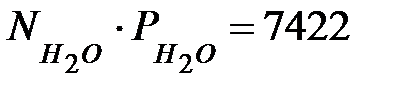 (0, 0074).
(0, 0074).
Плотность наружной среды:
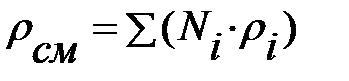
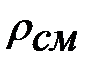 =1, 207+0, 0074+0, 000005
=1, 207+0, 0074+0, 000005  1, 214 кг/м3 .
1, 214 кг/м3 . 
Динамическая вязкость газовых составляющих при t = 0 оС, Па× с, (Приложение):
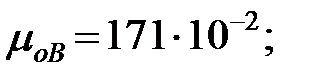
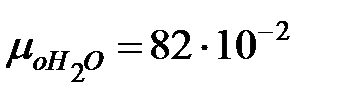 ;
; 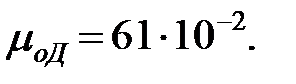
Константы Сатерленда (Приложение):
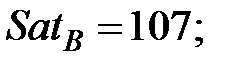



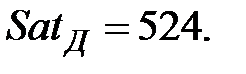
Динамическая вязкость газовых составляющих при t = 16 оC, Па× с;

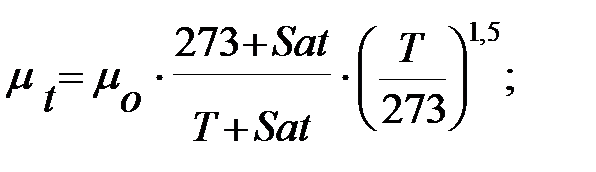
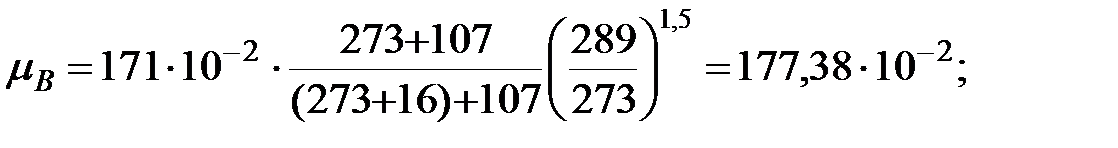
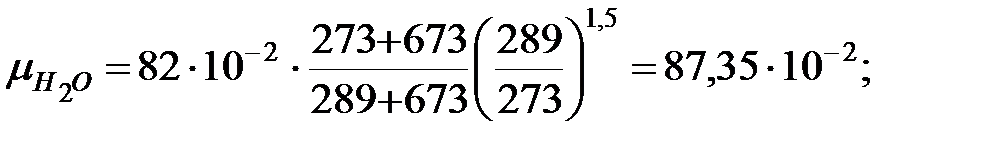
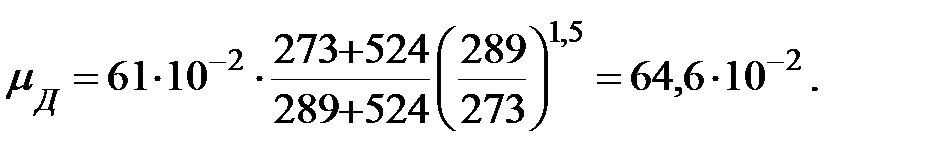
Относительная молекулярная масса смеси газов наружной среды:
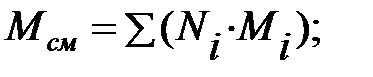

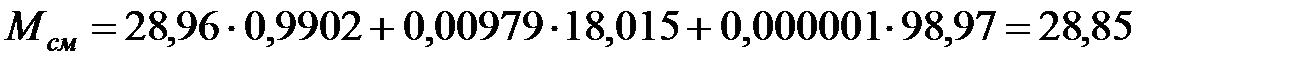
 Динамическая вязкость смеси газов наружной среды:
Динамическая вязкость смеси газов наружной среды:
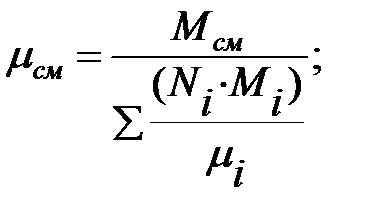

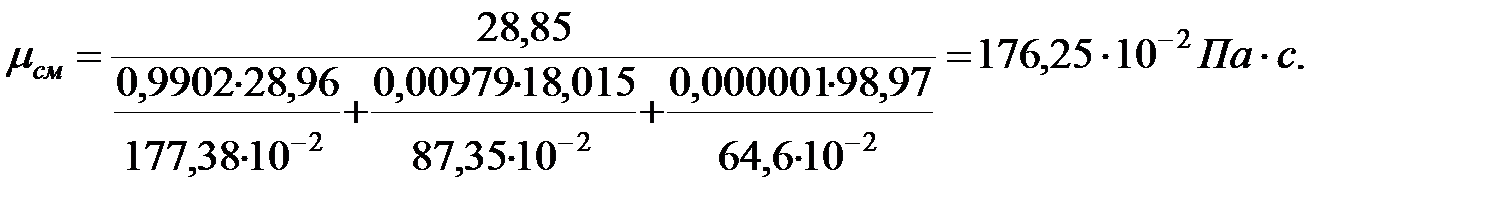
Кинематическая вязкость смеси газов наружной среды:
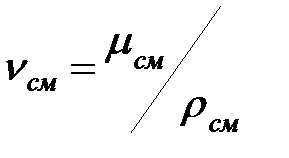
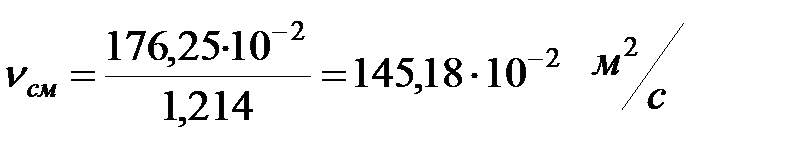 .
.
Коэффициент диффузии компонентов наружной среды при t = 0 оC и Р = 101308 Па, м2/ч:
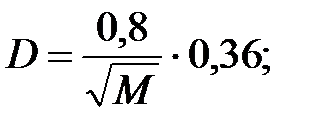
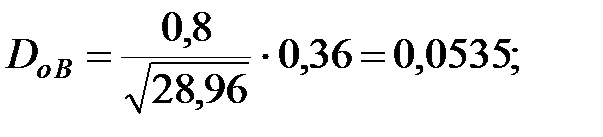
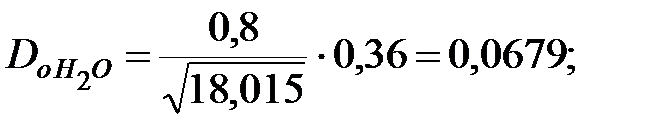
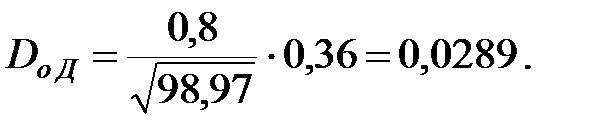
Коэффициент диффузии компонентов наружной среды при t = 16 оC и Р=В=101325 Па, м2/ч:
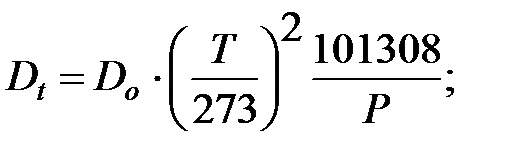
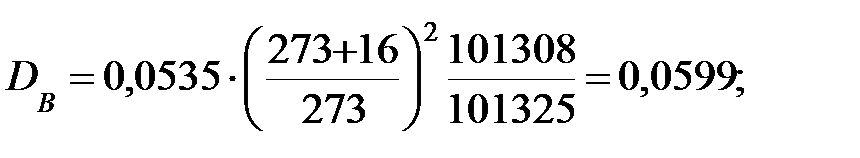
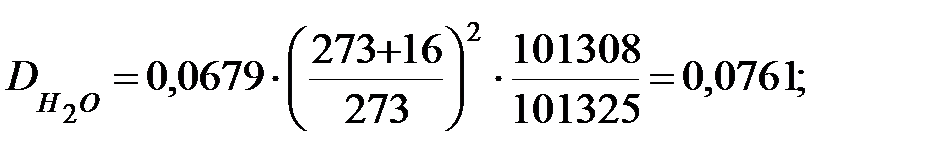
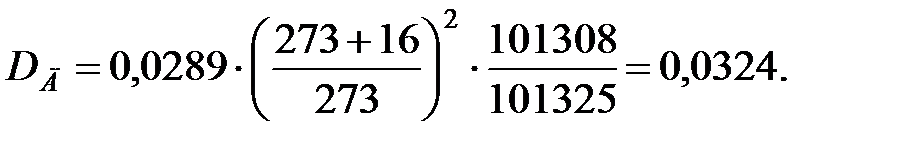
Пример 1.2. Определить параметры внутренней среды в трубопроводе, транспортирующем газовую смесь.
Исходные данные. Давление наружной среды В = 101325 Па; состав смеси, % масс.: водород 58, 9, α Н2 = 0, 589; оксид углерода 7, 1, α СО = 0, 071; метан 34, α СН4 = 0, 34. Температура газовой смеси t = 50 оС. Избыточное давление в трубопроводе Ризб = 101325 Па.
Решение. Молекулярные массы составляющих газовой смеси: МН2 = 2; МСО = 28; МСН4 = 16.
Объемные доли составляющих газовой смеси:
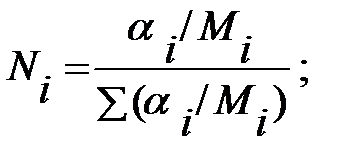

Абсолютное давление газовой смеси в трубопроводе:
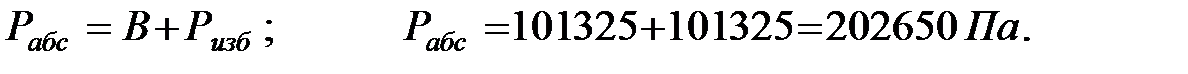
Парциальное давление составляющих газовой смеси, Па:
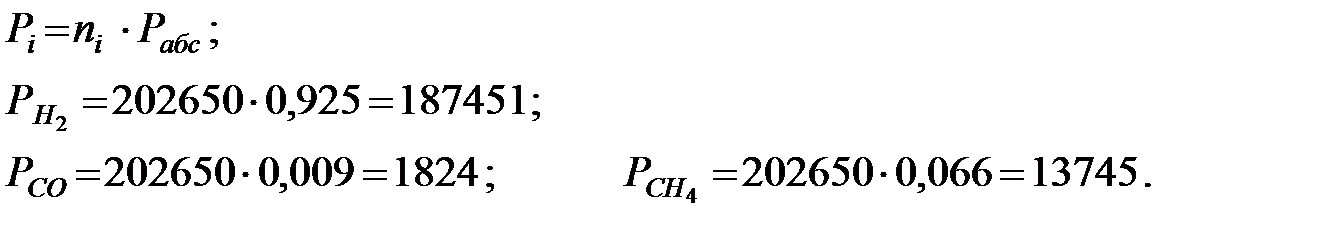
Концентрации составляющих газовой смеси, мг/м3:

Произведение Ni∙ ρ i для составляющих газовой смеси, мг/м3 (кг/м3):
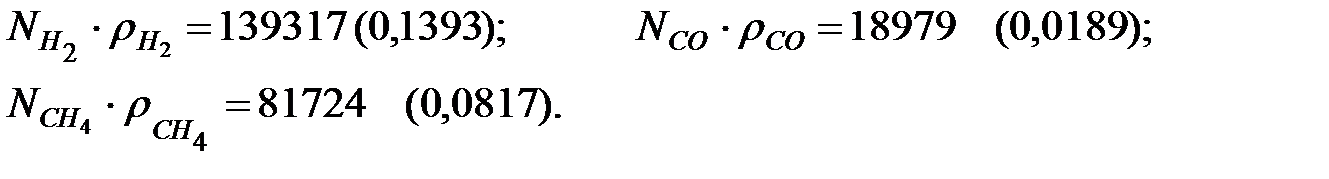
Плотность газовой смеси в трубопроводе:
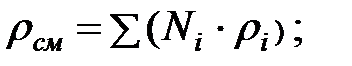
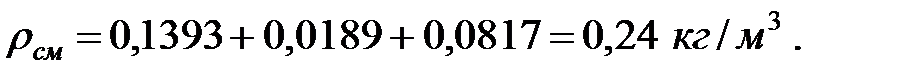
Динамическая вязкость составляющих газовой смеси при t = 0 oC и Рo = 101308 Па, Па·с:
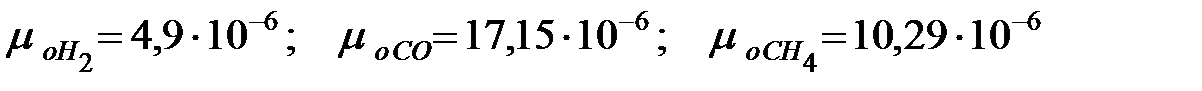
Константы Сатерленда:
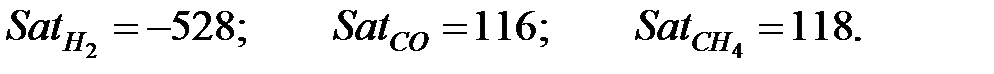
Динамическая вязкость составляющих газовой смеси при t = 50 oC, Па∙ с:
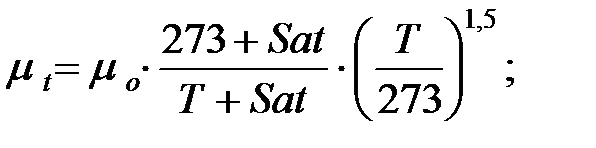
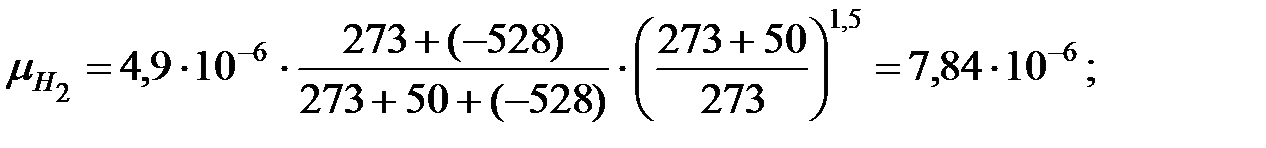
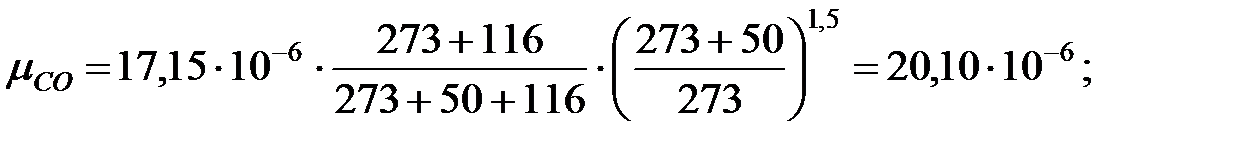
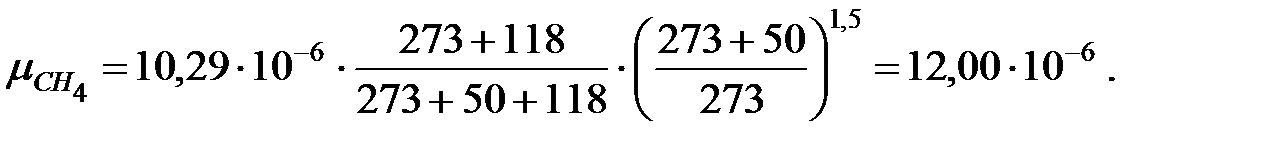
Молекулярная масса смеси газов в трубопроводе:
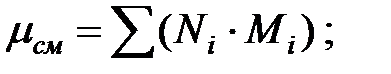
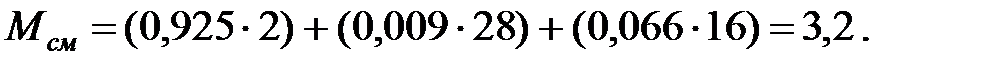
Динамическая вязкость смеси газов в трубопроводе:
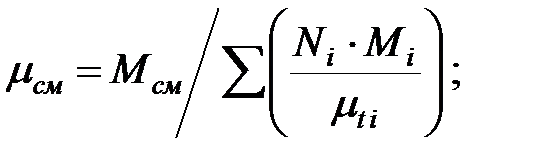
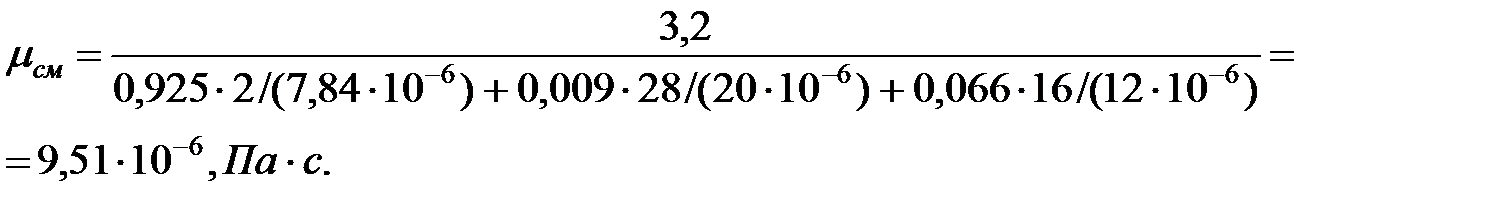
Кинематическая вязкость смеси газов в трубопроводе:
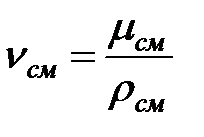
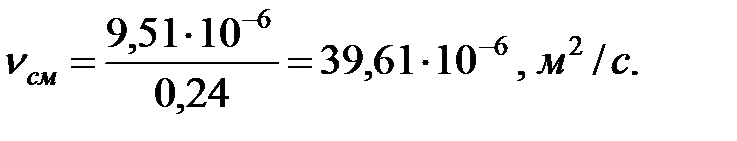
Коэффициенты диффузии составляющих газовой смеси при t = 0 oC и Рo = 101308 Па, м2/ч:
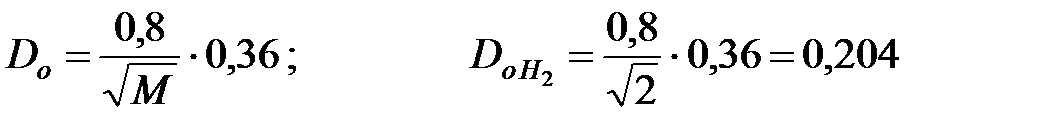

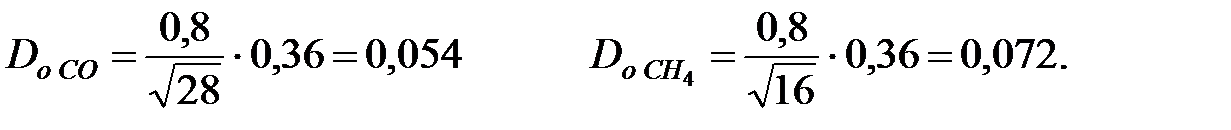
Коэффициенты диффузии составляющих газовой смеси при t = 50 oC и Р = 202650 Па, м2/ч:
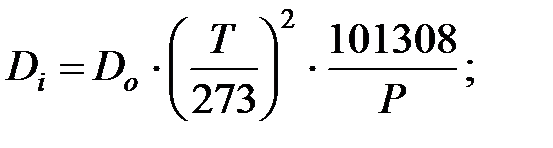
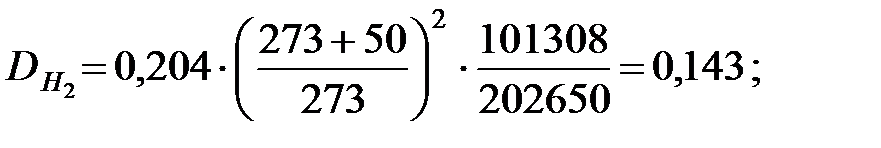
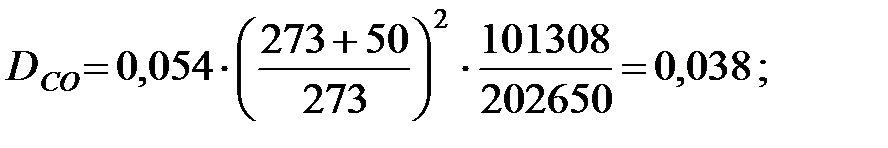
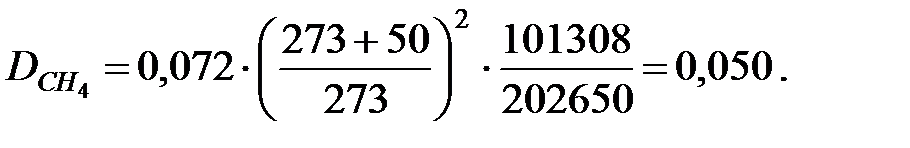
Пример 1.3. Определить параметры среды над открытой поверхностью жидкости в наружной среде.
Исходные данные. Давление наружной среды В = 101325 Па. Состав жидкости, % масс.: вода 40, aН2О = 0, 4; бензол 30, aБ = 0, 3; дихлорэтан 30, aД = 0, 3. Температура жидкости t = 40 oC. Наружная среда – воздух. Влажность воздуха j = 60 %. Температура воздуха t = 16 оС.
Молекулярные массы составляющих среды: МН2О = 18, 02; МБ = 78, 1; МД = 98, 97; МВ = 28, 96.
Решение
Мольные доли составляющих компонентов жидкости:
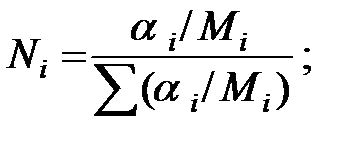
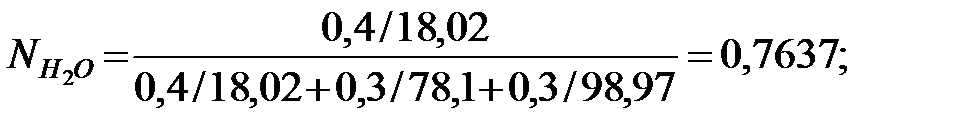

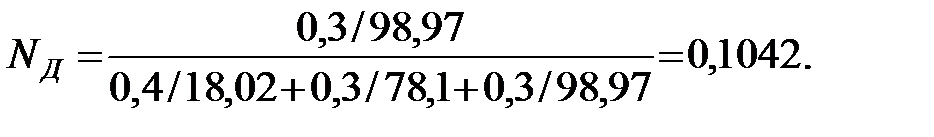
Из Приложения находим эмпирические коэффициенты А, В, С для каждого компонента смеси:
| Вода | А = 7, 9608; | В = 1678, 0; | С = 230, 0; |
| Бензол | А = 6, 9120; | В = 1214, 6; | С = 221, 2; |
| Дихлорэтан | А = 7, 1840; | В = 1358, 5; | С = 232, 0. |
Давление насыщенного пара чистого вещества при заданной температуре:
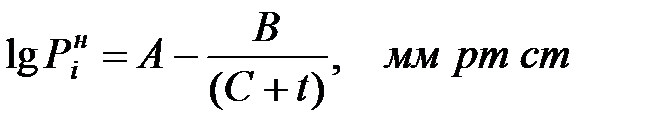
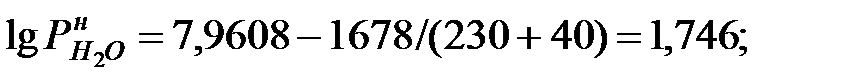
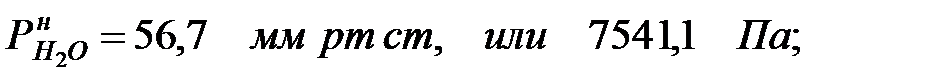
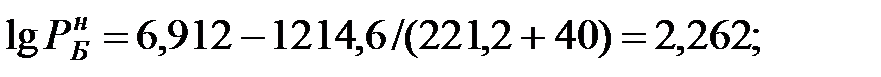
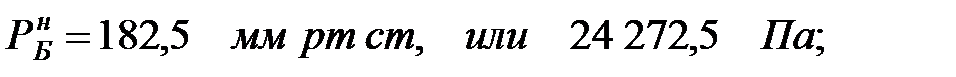
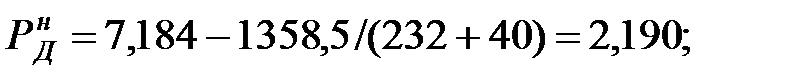
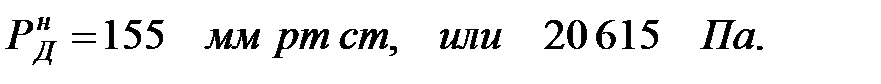
Парциальное давление паров компонента над смесью жидкостей:
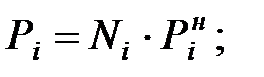
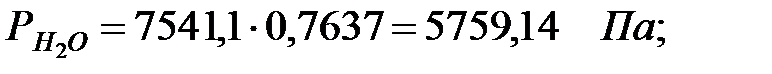
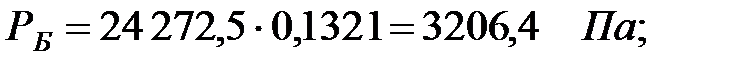
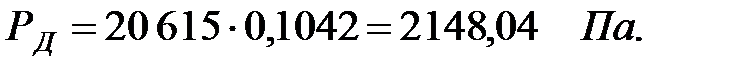
Парциальное давление основного газового компонента – воздуха:
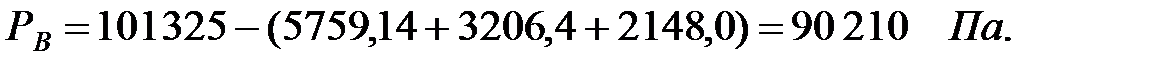
Объемные (мольные) доли газовых составляющих над жидкостью:
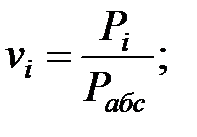
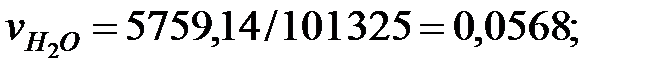
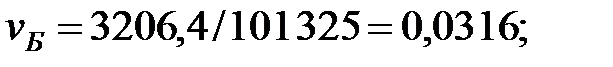
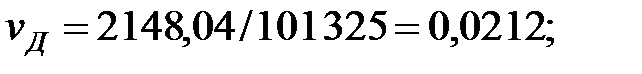
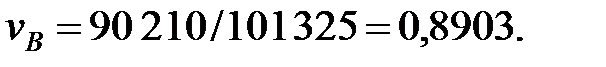
Концентрации составляющих газовой смеси над жидкостью:
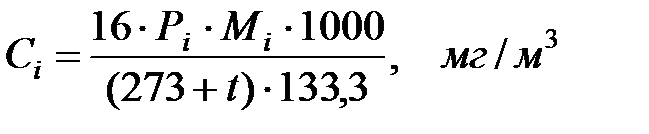
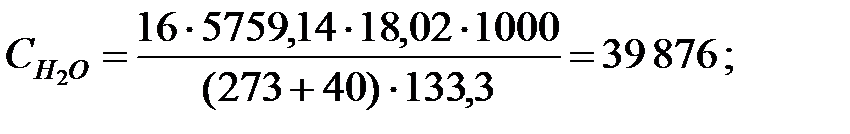
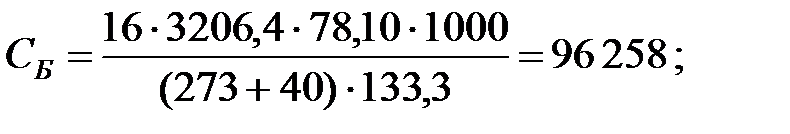
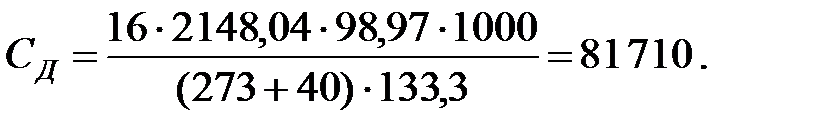
Произведение 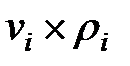 для составляющих газовой смеси над жидкостью, мг/м3 (кг/м3):
для составляющих газовой смеси над жидкостью, мг/м3 (кг/м3):
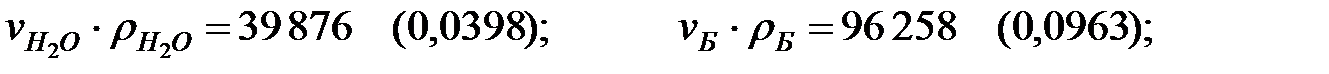
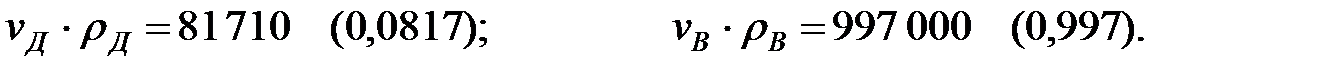
Плотность газовой смеси над жидкостью (с учетом температуры жидкости):
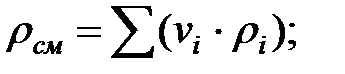

Динамическая вязкость составляющих газовой смеси над жидкостью при 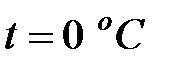 (Приложение), Па∙ с:
(Приложение), Па∙ с:


Константы Сатерленда (Приложение):
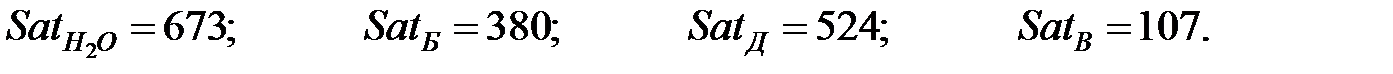
Динамическая вязкость составляющих газовой смеси над жидкостью при 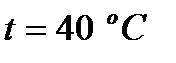 , Па·с:
, Па·с:
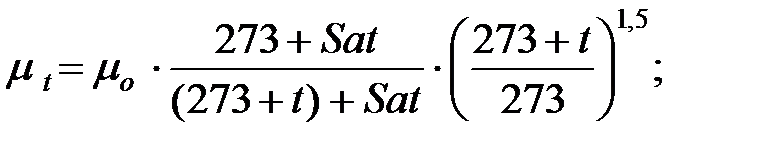
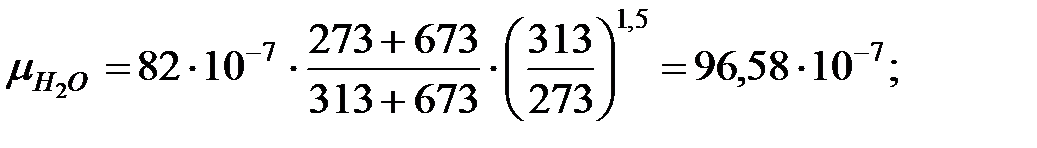
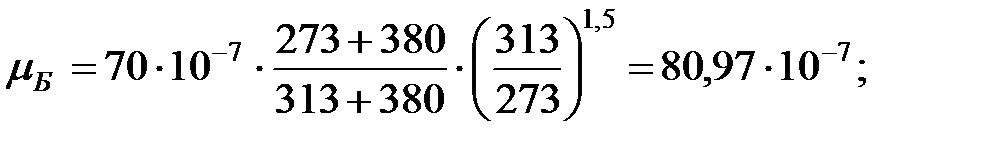
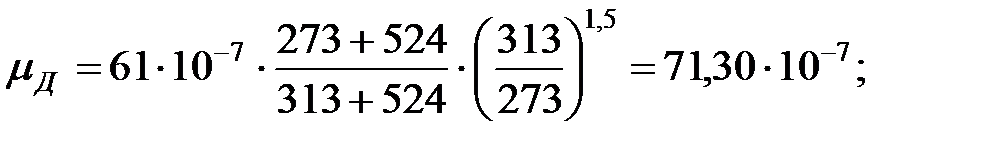
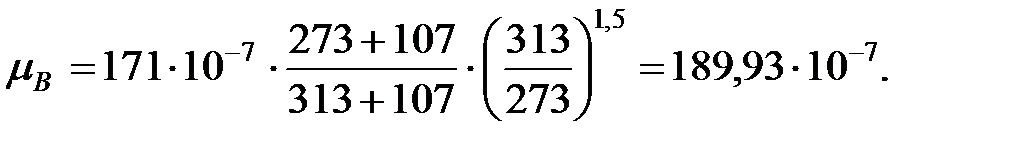
Молекулярная масса смеси газов над жидкостью:
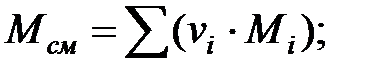
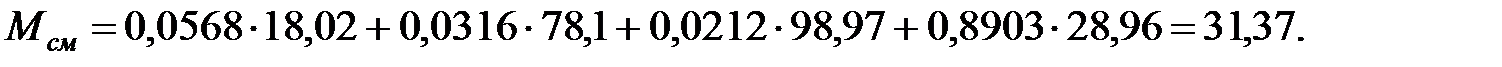
Динамическая вязкость смеси газов над жидкостью, Па·с:
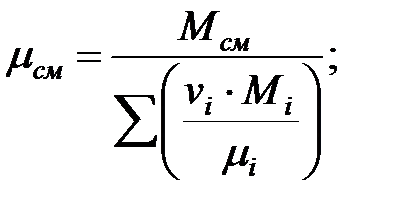

Кинематическая вязкость смеси газов над жидкостью, м2/с:
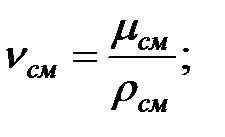
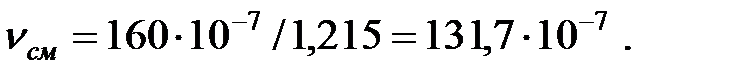
Коэффициенты диффузии компонентов газовой смеси над жидкостью при t = 0 oC и Рo = 101 308 Па, м2/ч:
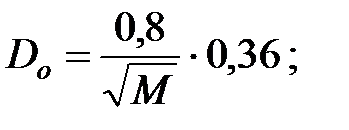
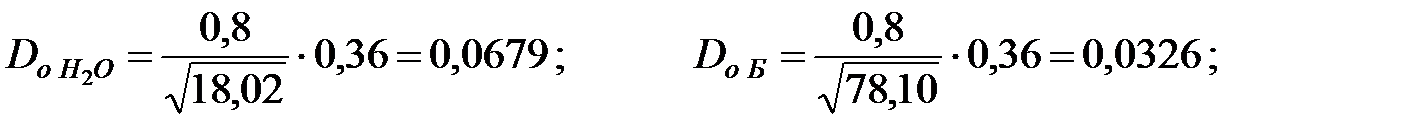
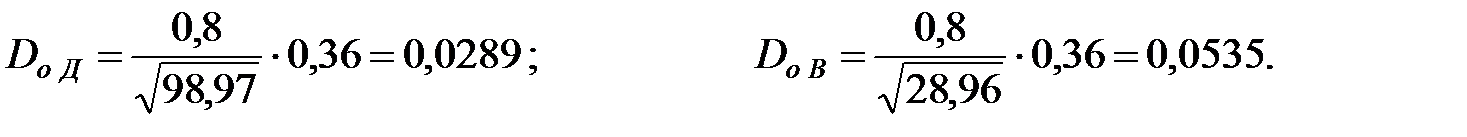
Коэффициенты диффузии компонентов газовой смеси над жидкостью при t = 40 oC и Р = 101 325 Па, м2/ч:
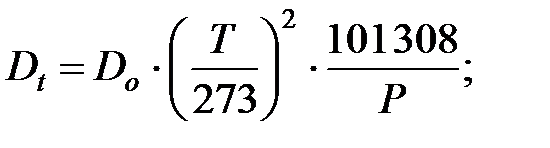
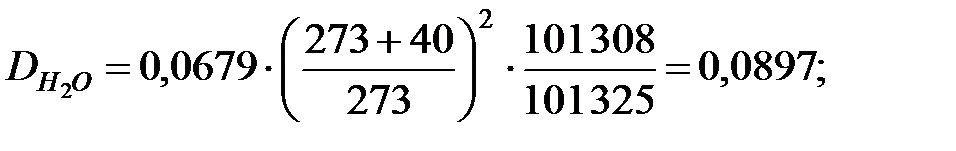
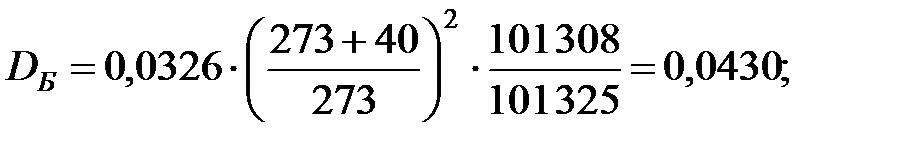
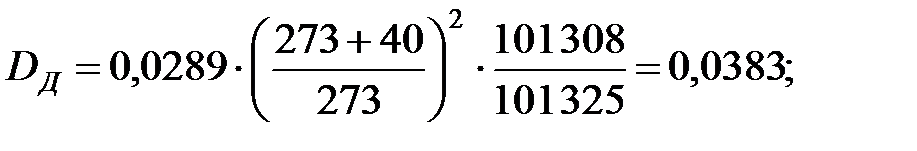
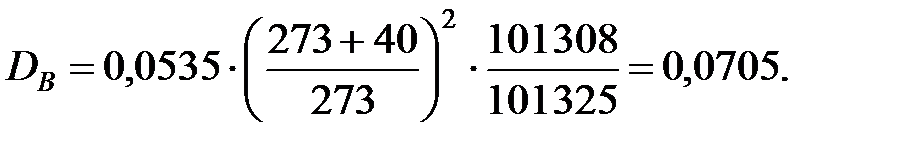
2.РАСЧЕТЫ ВЫБРОСОВ В АТМОСФЕРУ ЗАГРЯЗНЯЮЩИХ ВЕЩЕСТВ ИЗ РАЗЛИЧНЫХ ИСТОЧНИКОВ
Поступление вредных веществ в воздух может быть вызвано следующими физико-химическими процессами: истечением вследствие разности давлений в оборудовании и наружной среды, турбулентным и молекулярным переносом в результате разности парциальных давлений, при неполном сжигании различных видов топлива, при механической обработке, при химических реакциях и т.д.
Количество выделяющихся веществ в зависимости от поставленной задачи и требуемой степени точности можно определить исходя из удельных показателей, газовоздушных балансов, а также расчетным путем.
2.1. Расчет количества вредных веществ, поступающих из газового объема трубопроводов и оборудования, находящихся под давлением
2.1.1. Определение количества вредных веществ, поступающих через неплотности фланцевых соединений при Ризб ≥ 2 ∙ 105 Па
Количество газовой смеси, выделяющейся через неплотности фланцевых соединений, определяется по формуле:
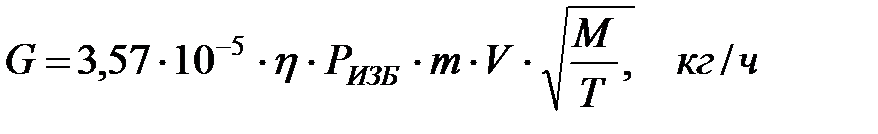 (2.1)
(2.1)
где 3, 57 –коэффициент, оС1/2 ∙ см2/(м3 ∙ ч);
η - коэффициент запаса, принимаемый равным 2;
Ризб – избыточное давление, Па;
m – коэффициент негерметичности, характеризующий падение давления в аппарате, ч-1;
V – объем аппарата, занимаемый газовой (паровой) фазой, м3;
Т – абсолютная температура газа или пара в аппарате, К;
М – молярная масса газа или пара.
Допустимые значения коэффициентов негерметичности приведены в табл. 2.1.
Таблица 2.1. Допустимые значения коэффициентов негерметичности
| Емкость | Среда | Коэффициент негерметичности, ч-1 |
| Газовые компрессоры, технологическое оборудование с трубопроводами и другое оборудование, работающее под давлением: | ||
| вновь установленные | Токсичная | 0, 001 |
| Пожаро- и взрывоопасная | 0, 002 | |
| повторное испытание | То же | 0, 005 |
| Трубопроводы для горючих, токсичных и сжиженных газов и паров: | ||
| цеховые | Токсичная и горючая | 0, 0005 |
| Горючая | 0, 001 | |
| межцеховые | Токсичная и горючая | 0, 001 |
| Горючая | 0, 001 |
2.1.2. Определение количества вредных веществ, поступающих через неплотности фланцевых соединений при 2 ∙ 105 > Ризб ≥ 0, 02 ∙ 105 Па
Количество газовой смеси, выделяющейся через неплотности фланцевых соединений, приближенно определяется по формуле для Ризб ≥ 2 ∙ 105 Па, но с коэффициентом запаса η = 1, 5:
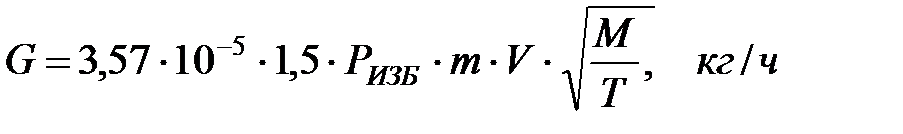 (2.2)
(2.2)
Пример 2.1. Определить количество вредных веществ, выделяющихся через неплотности фланцевых соединений вновь смонтированного трубопровода (d = 108 мм, толщина стенки - 4 мм, длина - 150 м).
Исходные данные. Состав среды в трубопроводе, % масс.: водород 58, 9, оксид углерода 7, 1, метан 34. Температура газовой смеси в трубопроводе t = 50 oC. Избыточное давление в трубопроводе Ризб = 209060 Па. Давление наружной среды В = 101325 Па.
Решение. Относительные молекулярные массы составляющих газовой смеси: МH2 = 2, 0; МCO = 28, 0; МCH4 = 16, 0.
Мольные доли составляющих газовой смеси:
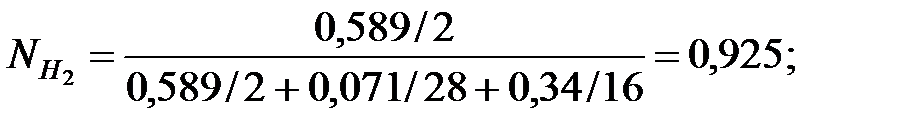
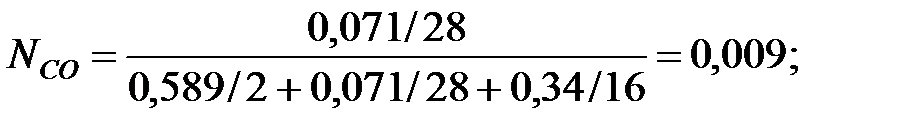
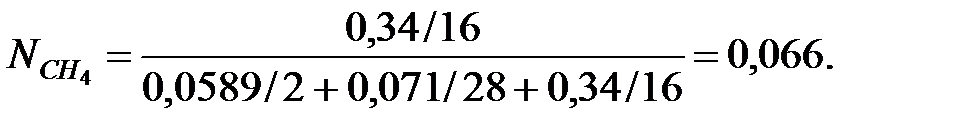
Абсолютное давление газовой смеси в трубопроводе:
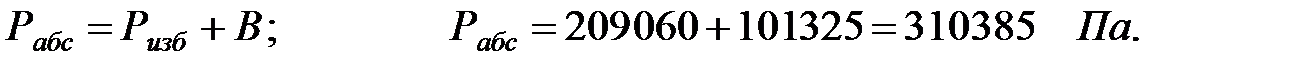
Парциальное давление составляющих газовой смеси:
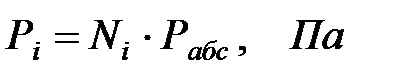
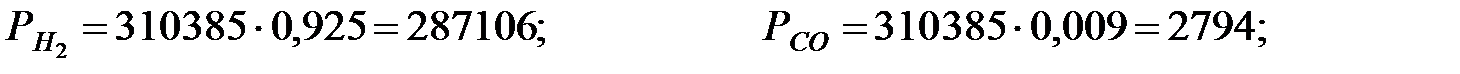
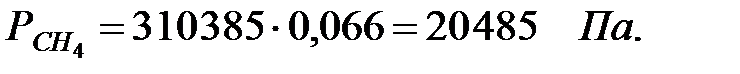
Концентрации составляющих газовой смеси:
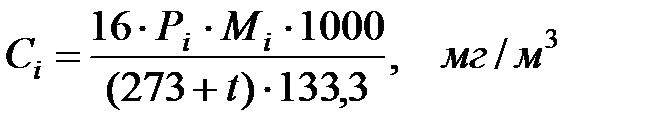
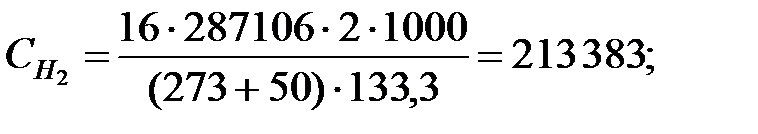
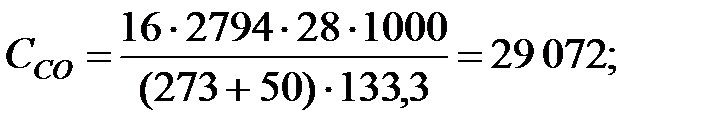
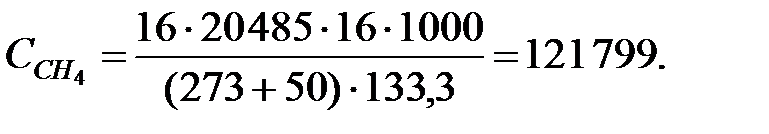
Произведение 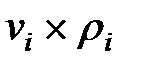 для составляющих газовой смеси, мг/м3 (кг/м3):
для составляющих газовой смеси, мг/м3 (кг/м3):
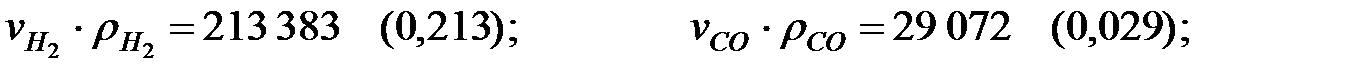
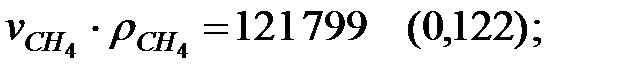
Плотность газовой смеси в трубопроводе:
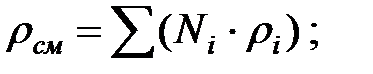
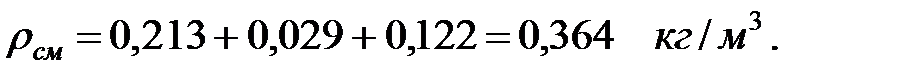
Молекулярная масса газовой смеси в трубопроводе:
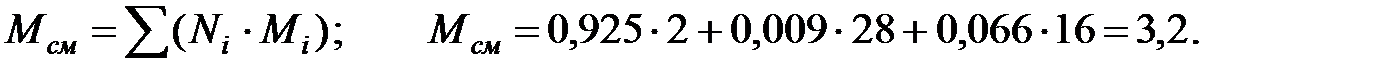
Коэффициент негерметичности фланцевых соединений трубопровода (табл. 2.1): m = 0, 001. Объем газов в трубопроводе: V = 0, 785× d2× l; V = 0, 785× 0, 12× 150 = 1, 1775 м3.
Количество газовой смеси, выделяющейся через неплотности фланцевых соединений трубопровода:
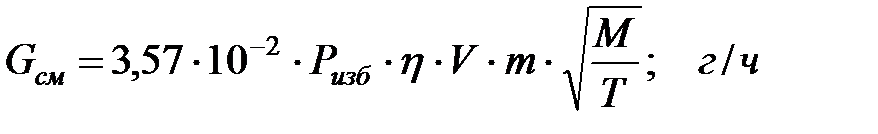
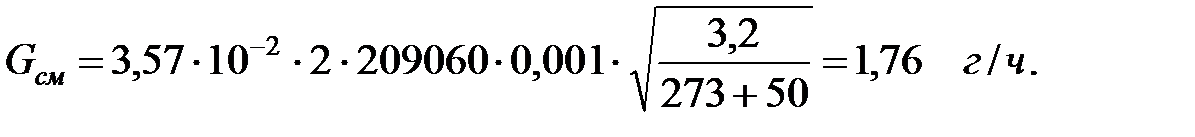
Объем газовой смеси, выделяющейся через неплотности фланцевых соединений трубопроводов:
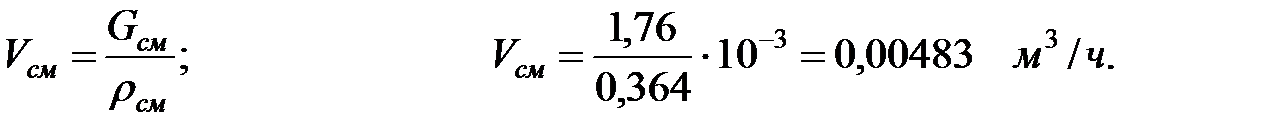
Количество составляющих газовой смеси, выделяющейся через неплотности фланцевых соединений трубопровода, г/ч:
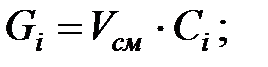
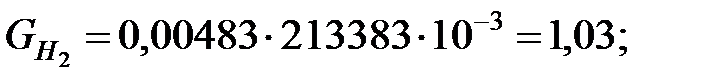
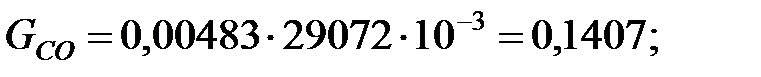
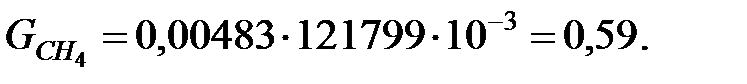
Пример 2.2. Определить количество вредных веществ, выделяющихся через неплотности фланцевых соединений из аппарата диаметром 1, 4 м и высотой 2, 5 м. Степень заполнения жидкостью kз = 0, 7.
Исходные данные. Состав жидкости в аппарате, % (масс.): вода 40, бензол 30, дихлорэтан 30. Газовая среда в аппарате – воздух с примесью аммиака. Влажность воздуха φ = 50 %. Концентрация аммиака в воздухе CNH3 = 10 мг/м 3. Температура жидкости и газовой среды в аппарате t = 40 оC. Давление наружной среды В = 101325 Па. Избыточное давление среды в аппарате Ризб = 101325 Па.
Решение. Молекулярные массы составляющих газовой среды: МН2О = 18, 015; МБ = 78, 10; МД = 98, 97; МВ = 28, 96; МNH3 = 17, 81.
Мольные доли составляющих жидкости:
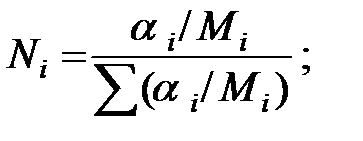
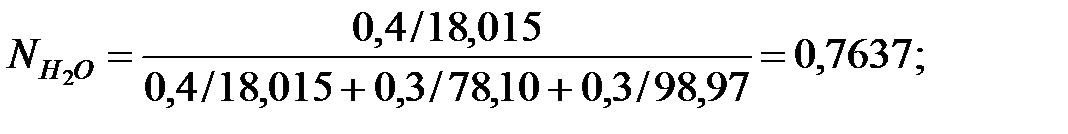
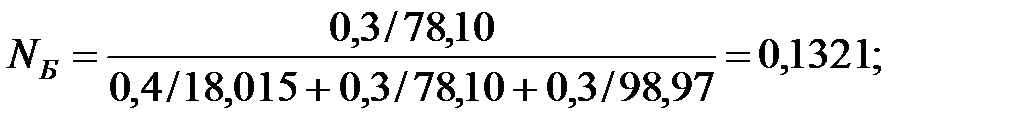
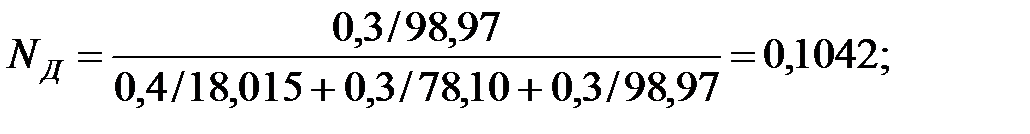
Из Приложения находим эмпирические коэффициенты А, В, С для каждого компонента смеси жидкости:
| Вода | А = 7, 9608; | В = 1678, 0; | С = 230, 0; |
| Бензол | А = 6, 9120; | В = 1214, 6; | С = 221, 2; |
| Дихлорэтан | А = 7, 1840; | В = 1358, 5; | С = 232, 0. |
Парциальное давление насыщенных паров компонентов над чистыми жидкими веществами:
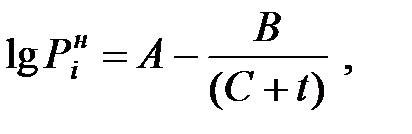
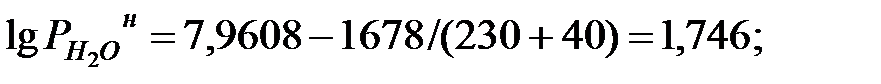
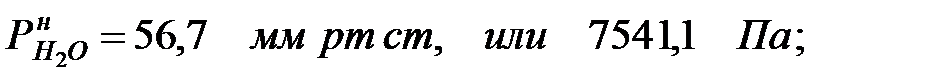
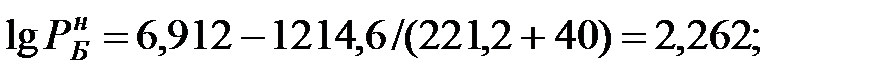
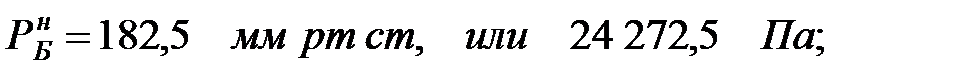
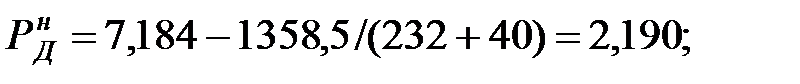
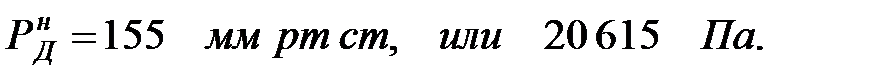
Парциальное давление паров компонента над смесью жидкостей (поступивших из жидкости):
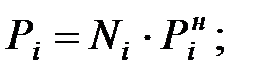
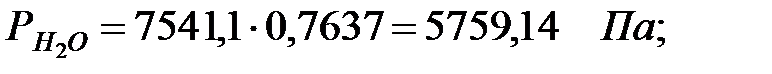
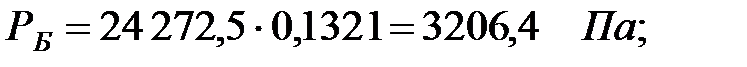
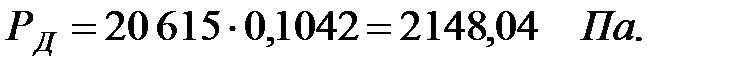
Парциальное давление насыщенных водяных паров в газовой среде:

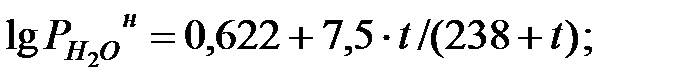
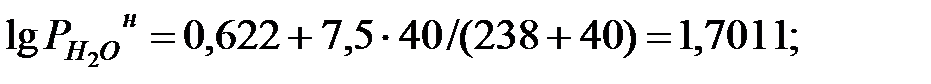
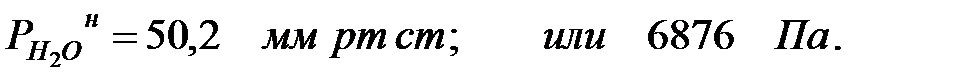
Давление водяных паров в газовой среде при заданной влажности:
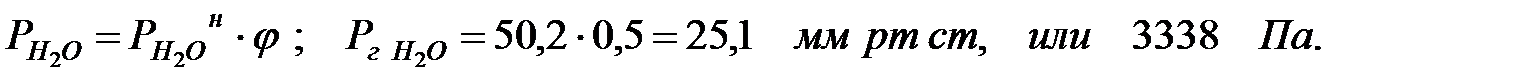
Полное давление среды в аппарате:
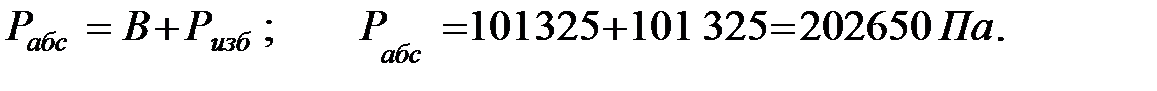
Парциальное давление примеси (аммиака) в газовой фазе:
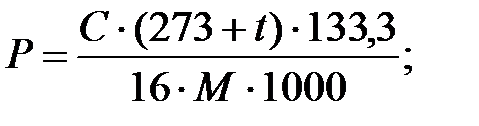
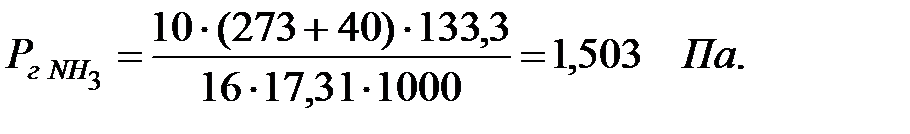
В таблице 2.2 приведены возможные парциальные давления компонентов в газовой смеси над жидкостью.
Таблица 2.2. Возможные парциальные давления компонентов над жидкостью
| Компоненты | Парциальные давления компонентов | Возможное парциальное давление | |
| поступивших из жидкости | в первоначальной газовой среде | ||
| Вода | |||
| Бензол | 3206, 4 | 3206, 4 | |
| Дихлорэтан | |||
| Аммиак | 1, 503 | 1, 503 |
Парциальное давление основного газового компонента – воздуха:
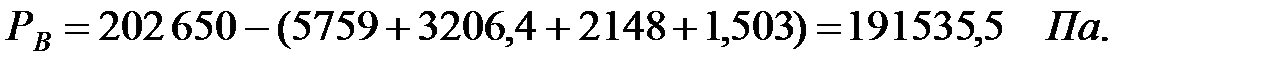
Объемные доли газовых составляющих:
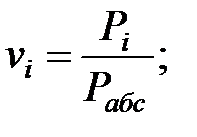
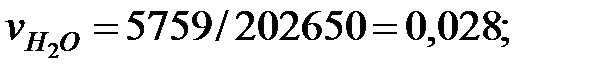
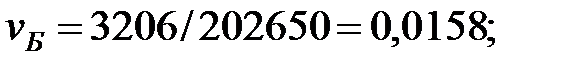
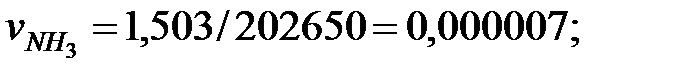
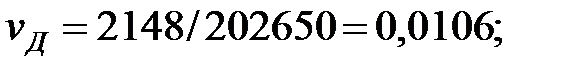
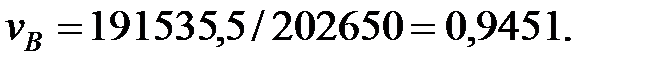
Концентрация составляющих газовой смеси, мг/м3:
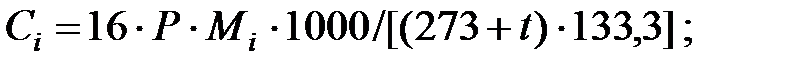
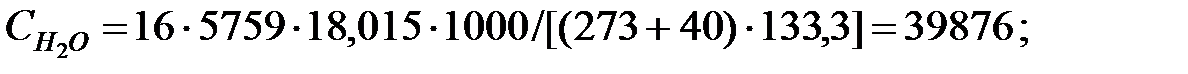
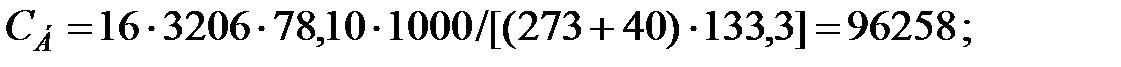
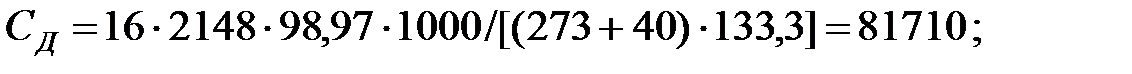
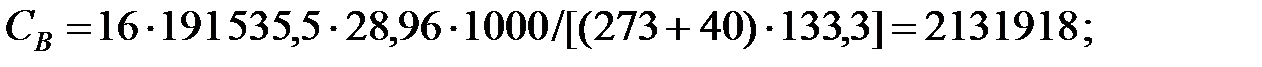
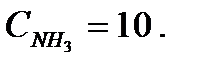
Произведение 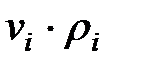 для составляющих газовой смеси, мг/м3 (кг/м3):
для составляющих газовой смеси, мг/м3 (кг/м3):
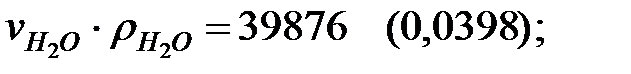
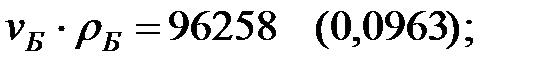
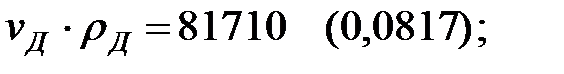
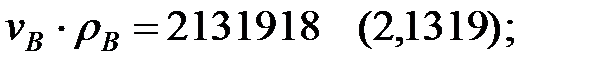
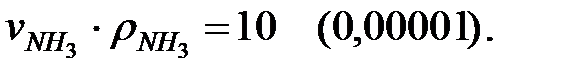
Плотность газовой смеси в аппарате:
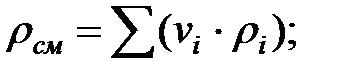
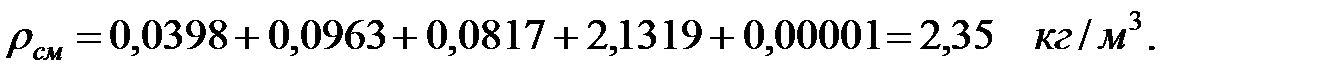
Молекулярная масса смеси газовв аппарате:
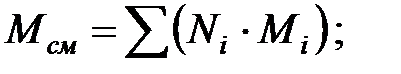
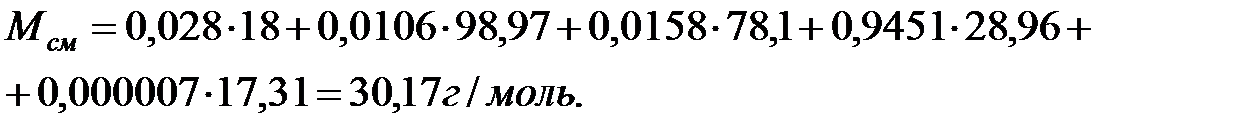
Объем занимаемый газовой фазой в аппарате:
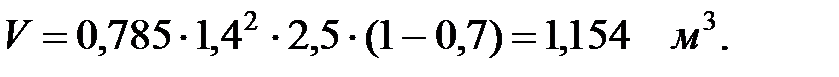
Коэффициент негерметичности аппаратов, подвергающихся повторному испытанию (существующий): m = 0, 005.
Количество газовой смеси, выделяющейся из аппарата:
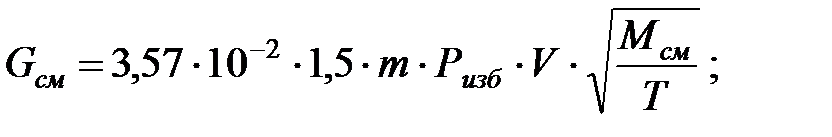
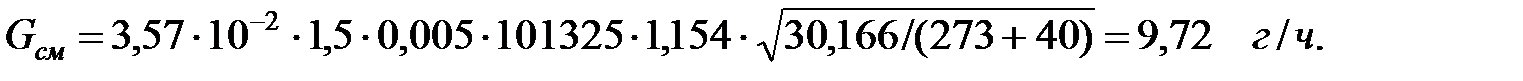
Объем газовой смеси, выделяющейся из аппарата:
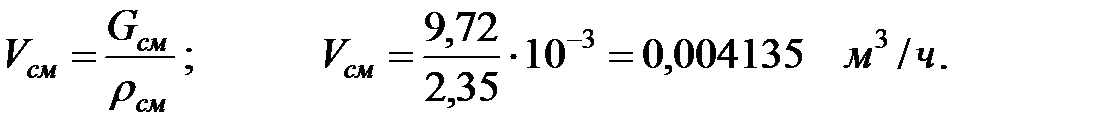
Количество составляющих газовой смеси, выделяющихся через неплотности фланцевых соединений аппарата, г/ч:
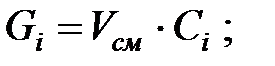
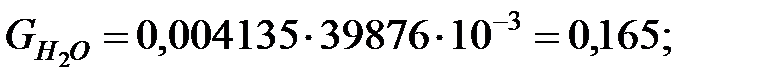
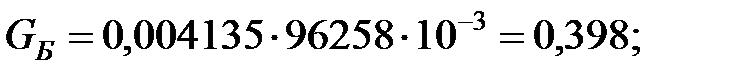
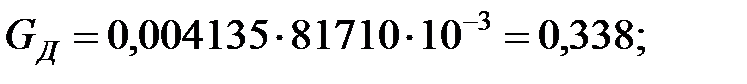
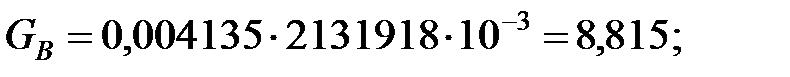
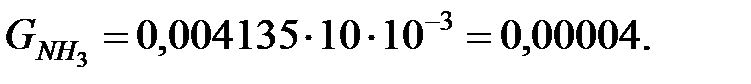
2.2. Расчет количества вредных веществ, поступающих в атмосферный воздух при «большом» и «малом дыхании» аппарата
2.2.1. Расчет количества вредных веществ, поступающих в атмосферный воздух при “большом дыхании” аппарата
«Большим дыханием» называют вытеснение паров наружу или подсос воздуха внутрь аппаратов при изменении в них уровня жидкости. Наполнение аппарата (например, резервуара) почти всегда происходит при постоянных температуре и давлении в емкости (Рраб). Объем вытесняемых газов (или паров при наполнении аппарата) будет:
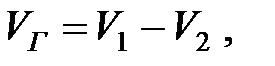 (2.3)
(2.3)
где V1 и V2 – объем газов или паров в аппарате перед и после его наполнения, м3.
Масса теряемых при дыхании газов или паров за цикл, кг/цикл:
 (2.4)
(2.4)
где ρ г.см – плотность газов или паров, кг/м3.
2.2.2. Расчет количества вредных веществ, поступающих в атмосферный воздух при «малом дыхании» аппарата
«Малым дыханием» называют вытеснение газов или паров наружу или подсос воздуха внутрь аппарата, вызываемые изменением температуры газов или паров под влиянием внешней среды. При «малом дыхании» уровень жидкости изменяются очень незначительно, следовательно, объем газового или парового пространства аппарата остается постоянным. Давление газовой смеси Pраб в аппарате также остается неизменным, так как её избыток удаляется через систему дыхательных клапанов.
Если весь период малого дыхания температура равномерно изменяется от t1 до t2, то равномерно изменяется и концентрация насыщенных паров от С1 до С2. Если температура при малом дыхании изменяется неравномерно, то весь период делят на небольшие отрезки времени и находят изменение температуры и соответствующие потери газовой смеси за каждый промежуток времени, а затем определяют общие потери. «Малое дыхание» характерно, главным образом, для аппаратов, расположенных вне помещений. Объем вытесняемых газов или паров при «малом дыхании» можно найти из следующего выражения:
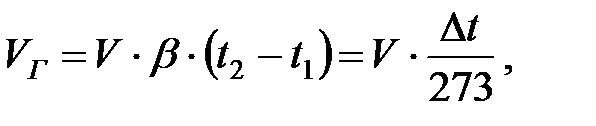 (2.5)
(2.5)
где VГ -увеличение объема газа или паров, м3;
V – объем газа или пара в аппарате над жидкостью, м3;
β - коэффициент объемного расширения;
Δ t – изменение температуры газа или пара над жидкостью.
Масса теряемого при дыхании вещества, кг/цикл, определяется из выражения:
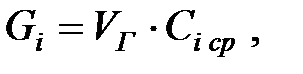 (2.6)
(2.6)
где Сi ср – средняя концентрация насыщенных паров определяемого вещества за период дыхания, г/м3 :
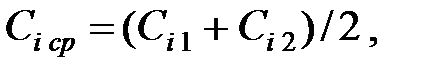 (2.7)
(2.7)
где Ci 1 и Сi 2 – концентрации насыщенных паров при t1 и t2.
Пример 2.3. Определить количество вредных веществ, выделяющихся через воздушку при «большом дыхании» аппарата.
Исходные данные. Состав жидкости в аппарате, % (масс.): вода 40; бензол 30 и дихлорэтан 30. Газовая среда в аппарате – воздух с примесью аммиака. Влажность воздуха φ = 50%. Концентрация аммиака в воздухе CNH3 = 10 мг/м3. Температура жидкости и газовой среды в аппарате t = 40 oC. Давление наружной среды В =101325 Па. Диаметр аппарата 1, 4 м. Высота аппарата 2, 5 м. Высота уровня жидкости перед заполнением 0, 2 м. Время заполнения аппарата 40 мин при степени заполнения kЗ = 0, 7.
Решение. По аналогии с решением примера 2.2 находим возможные парциальные давления компонентов в газовой смеси над жидкостью:
PH2O = 5759; PБ = 3206; PД = 2148; PNH3 = 1, 503 Па.
Парциальное давление основного газового компонента – воздуха:
РВ = 101325 - (5759+3206, 4+2148+1, 503) = 90210, 5 Па.
Концентрации составляющих газовой смеси, мг/м3:
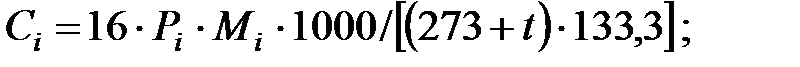
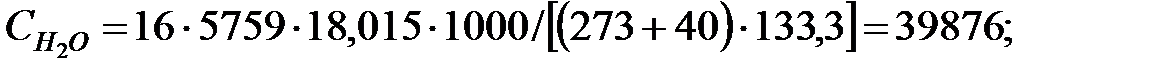
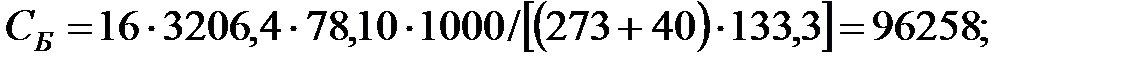
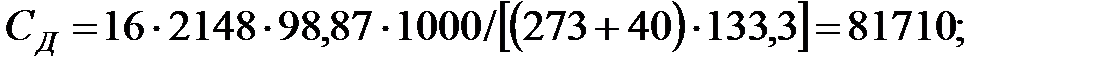
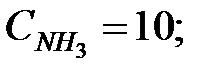
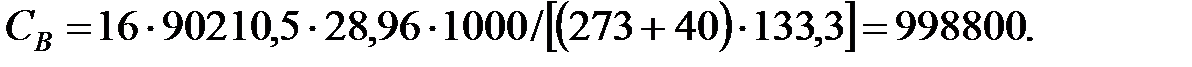
Объем газовой смеси перед заполнением аппарата:
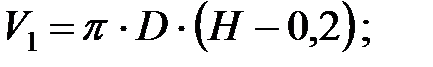
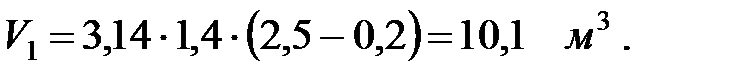
Объем газовой смеси после заполнения аппарата:
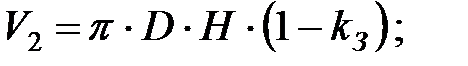
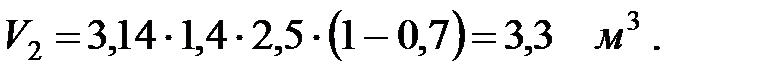
Объем вытесненной газовой смеси из аппарата за 40 мин:
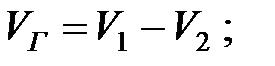
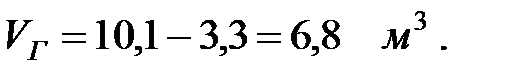
Количество составляющих газовой смеси, вытесненных из аппарата за 40 мин:
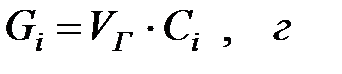
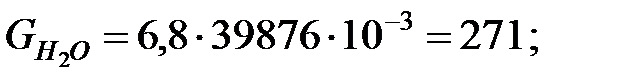
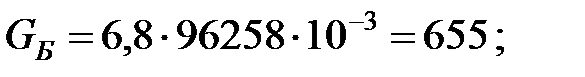
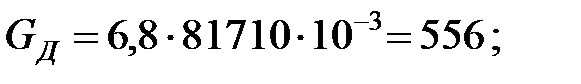
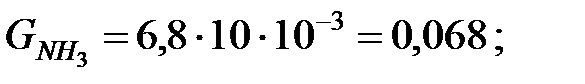
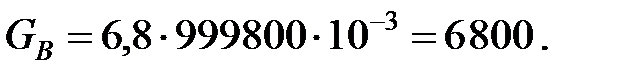
Пример 2.4. Определить количество вредных веществ, поступающих в атмосферный воздух через воздушку аппарата при изменении в течении 1 ч температуры жидкости и газовой среды в аппарате с 40 до 42 оС.
Исходные данные. Состав жидкости в аппарате, % (масс): вода 40; бензол 30 и дихлорэтан 30. Газовая среда в аппарате – воздух с примесью аммиака. Влажность воздуха φ = 50%. Концентрация аммиака в воздухе СNH3 = 10 мг/м3. Давление наружной среды В = 101325 Па. Диаметр аппарата 1, 4 м, высота аппарата 2, 5 м. Степень заполнения аппарата жидкостью kЗ = 0, 7.
Решение. Относительные молекулярные массы составляющих газовой и жидкой сред: МH2O = 18, 015; MБ = 78, 10; MД = 98, 97; MB = 28, 96; MNH3 = 17, 31.
Мольные доли составляющих жидкости:
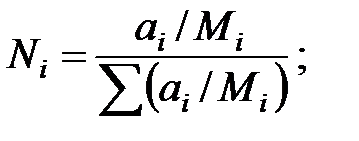
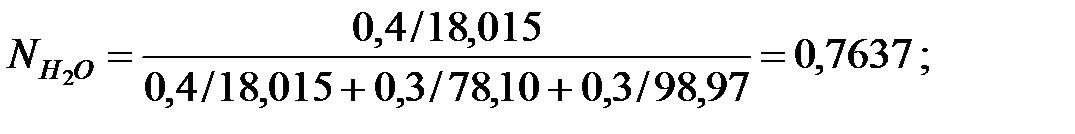
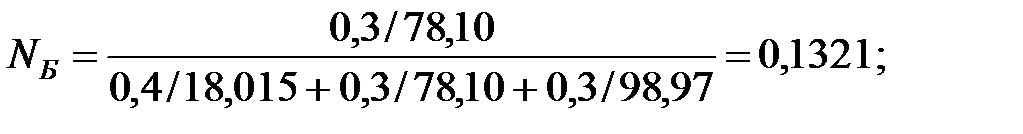
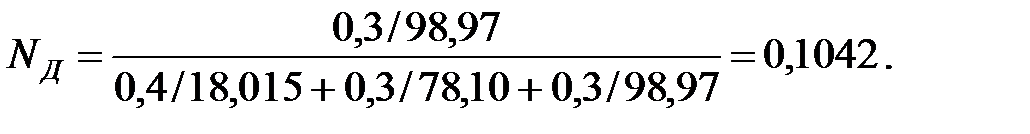
Из Приложения находим эмпирические коэффициенты для каждого компонента смеси жидкостей:
| Вода | А = 7, 9608; | В = 1678; | С = 230; |
| Бензол | А = 6, 912; | В = 1214, 6; | С = 221, 2; |
| Дихлорэтан | А = 7, 184; | В = 1358, 5; | С = 232. |
Парциальное давление насыщенных паров компонентов над чистыми жидкими веществами:
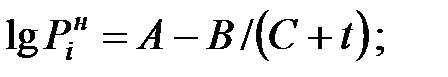
при t = 40 оС:
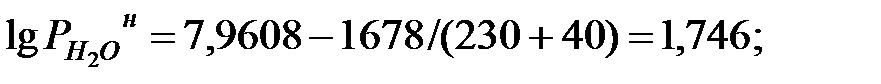
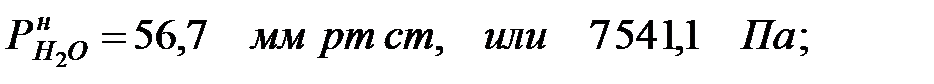
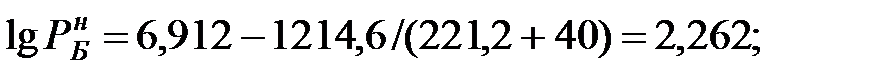
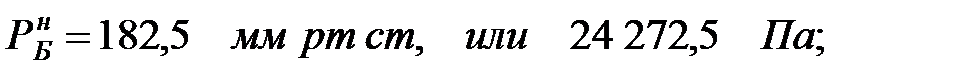
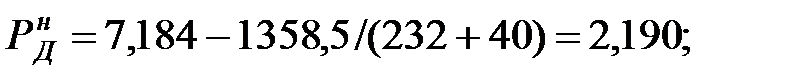
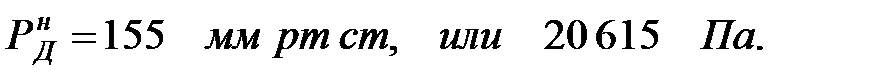
при t = 42 оС:
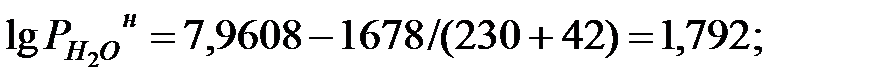
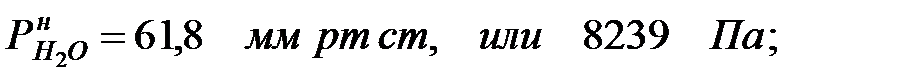
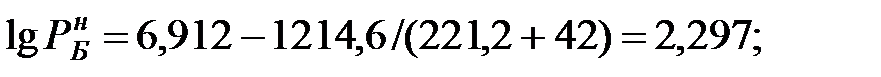
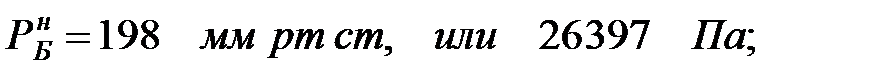
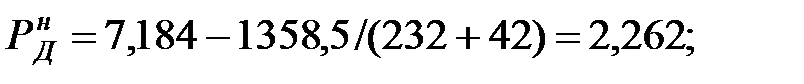

Парциальное давление паров компонентов над смесью жидкостей, Па:
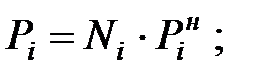
при t = 40 оС:
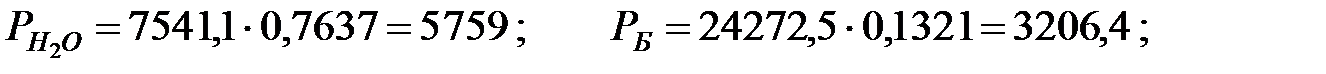
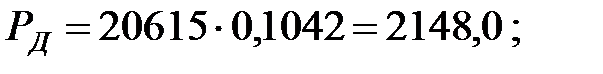
при t = 42 оС:
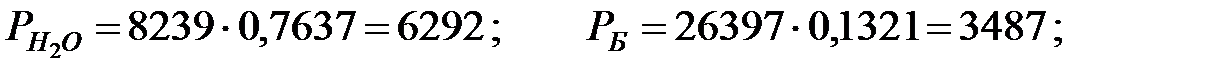
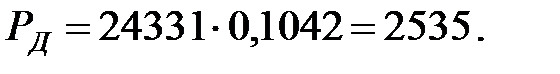
Парциальное давление насыщенных водяных паров в газовой среде:
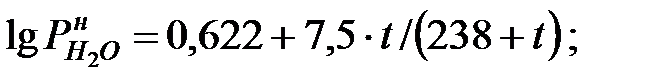
при t = 40 оС:
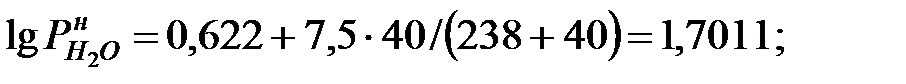
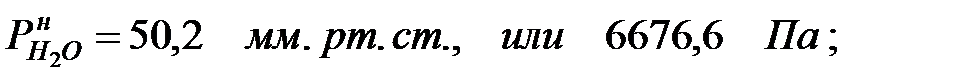
при t = 42 оС:
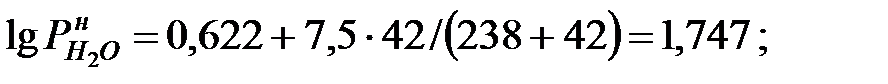
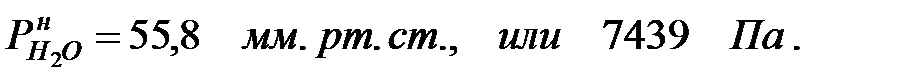
Таблица 2.3. Возможные парциальные давления компонентов газовой смеси над жидкостью
| Компонент | Парциальное давление компонентов, Па | Возможное парциальное давление, Па | |||
| поступающих из жидкости | в первоначальной газовой среде | ||||
| При t = 40 оC | |||||
| Вода | |||||
| Бензол | 3206, 4 | 3206, 4 | |||
| Дихлорэтан | |||||
| Аммиак | 1, 503 | 1, 503 | |||
| При t = 42 оC | |||||
| Вода | 3719, 5 | ||||
| Бензол | |||||
| Дихлорэтан | |||||
| Аммиак | 1, 52 | 1, 52 | |||
Парциальное давление водяных паров при заданной влажности:
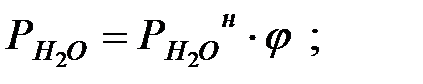
при t = 40 оС:
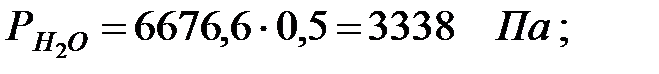
при t = 42 оС:
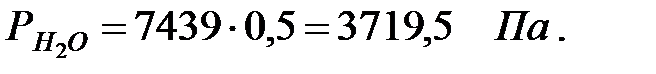
Парциальное давление примеси (аммиака) в газовой среде:
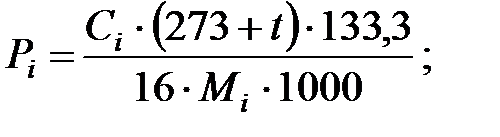
при t = 40 оС:
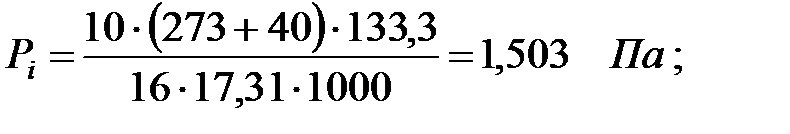
при t = 42 оС:
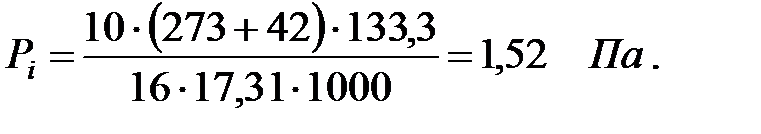
Возможные парциальные давления компонентов газовой смеси над жидкостью приведены в табл. 2.3.
Парциальные давленияосновного газового компонента воздуха:
при t = 40 оС:
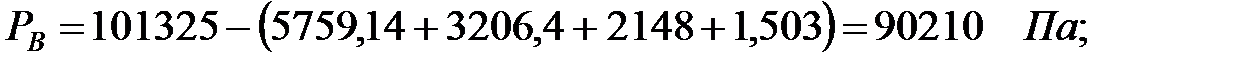
при t = 42 оС:
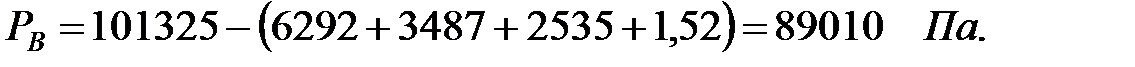
Концентрации составляющих газовойсмеси:
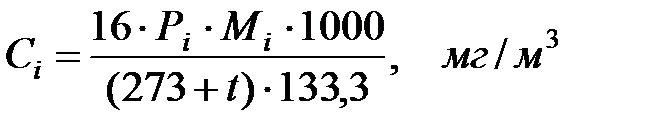
при t = 40 оС:
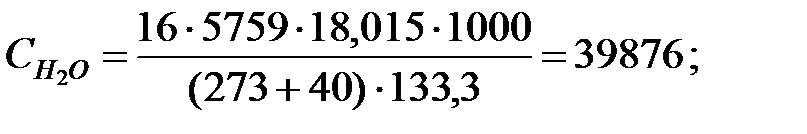
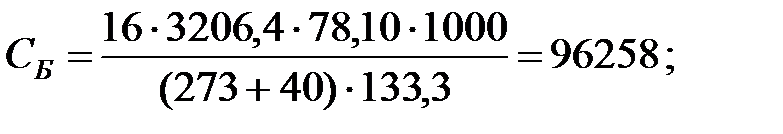
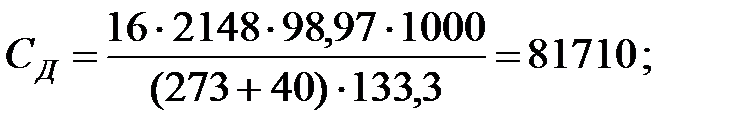
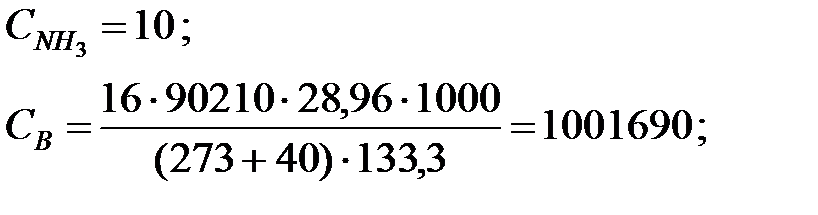
при t = 42 оС:
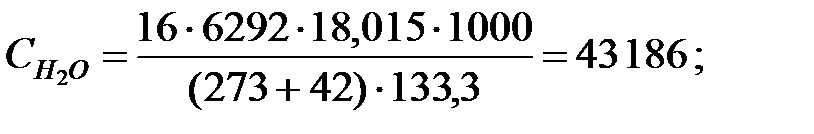

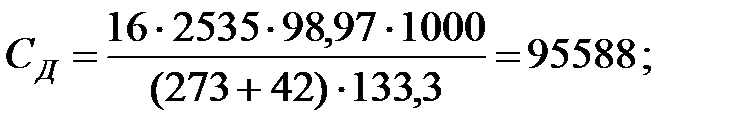
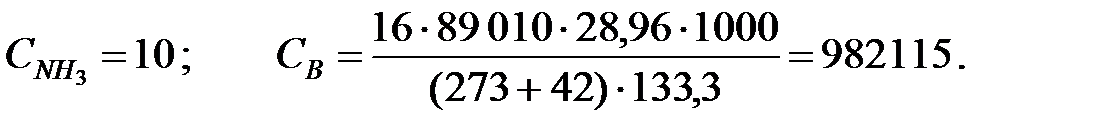
Средняя концентрация компонентов газовой смеси, мг/м3:
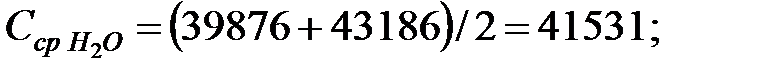
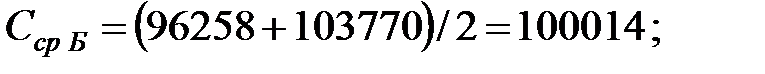
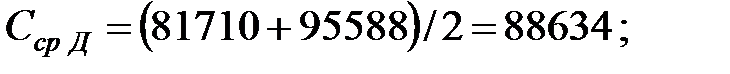
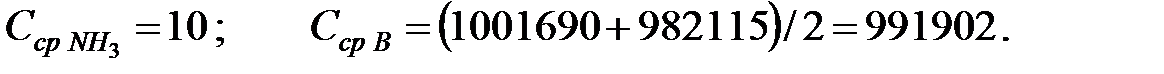
Объем газовой смеси в аппарате:
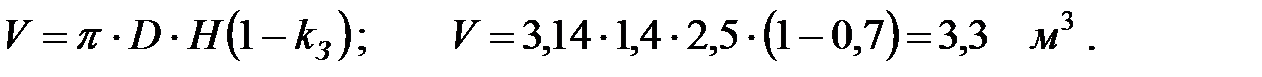
Изменение температуры газовой смеси в аппарате:
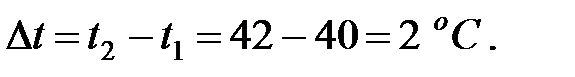
Увеличение объема газовой смеси при изменении температуры:
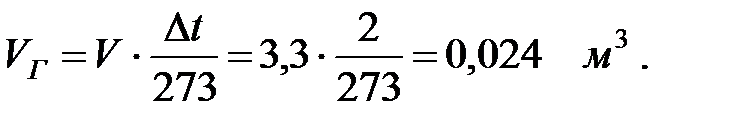
Количество составляющих газовой смеси, выделяющихся из аппарата при малом дыхании, г/ч:
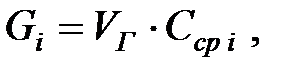
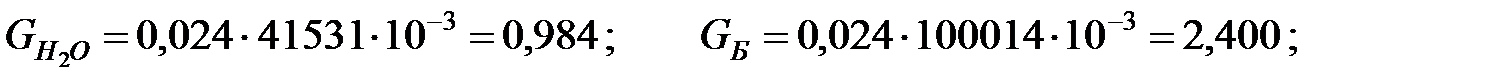
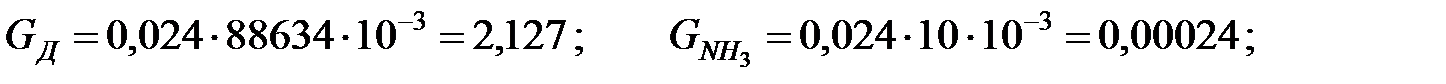
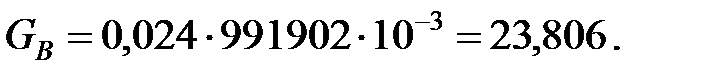
|
|