
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гальванические элементы
|
|
Если разделить пространственно процессы окисления и восстановления, то окислительно-восстановительную реакцию можно использовать для получения электрической энергии.
Устройство в котором, химическая энергия превращается в электрическую, называется гальваническим элементом. Гальванический элемент образуется из двух металлов, погруженными в раствор электролитов. Если соединить эти металлы проводником первого рода (металлический провод), то будет образовываться электрический ток, появляющийся вследствие возникновения окислительно-восстановительного процесса. В гальваническом элементе анодом служит электрод, электродный потенциал которого в данном растворе более электроотрицательный. На аноде происходит окисление. Катодом служит электрод из менее активного металла. На катоде восстановляются положительные ионы металлов, ионы водорода или нейтральные молекулы. В гальваническом элементе анод обозначается знаком «минус», а катод – знаком «плюс». Гальванический элемент показан на рисунке.
Цинковая пластинка опущена в раствор сульфата цинка, медная - в раствор сульфата меди. Пластинки соединены проводом, растворы разделены пористой перегородкой, чтобы не происходило смешение растворов. Электроны по внешней цепи идут от анода к катоду, а по внутренней цепи анионы SO42- перемещаются в растворе от меди к цинку, замыкая электрическую цепь гальванического элемента.
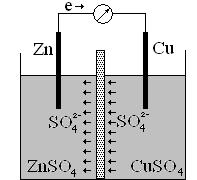
Гальванический элемент записывается в виде электрохимической схемы:
A(-) Zn | ZnSO4 || CuSO4 | Cu (+)K
Так как электродный потенциал цинка меньше электродного потенциала меди то цинк будет анодом, а медь – катодом. Цинковая пластинка окисляется, а на поверхности медной пластинки идёт восстановление меди из раствора.
Процессы, протекающие при работе гальванического элемента, следует записать:
A Zn – 2e = Zn2+
 K Cu2+ + 2e = Cu0
K Cu2+ + 2e = Cu0
Zn + Cu2+ = Zn2+ + Cu
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода:
ЭДС= еK - еA
Для медно-цинкового гальванического элемента в стандартных условиях:
ЭДС = 0, 34-(-0, 76)=1, 1 В
Разность потенциалов образуется не только между разными, но и между одноименными металлами, прогруженными в растворы своих солей с разными концентрациями. Такой гальванический элемент называется концентрационным. Например, никелевый концентрационный гальванический элемент.
(-)Ni | NiSO4 || NiSO4 | Ni (+)
0, 01моль 0, 1моль
Запишем работу такого концентрационного гальванического элемента.
еNi2+/Ni = е0 + (0, 058/n)lg(1*10-2) = -0.25 + (0, 058/2)(-2) = -0.308 В
еNi2+/Ni = е0 + (0, 058/n)lg(1*10-1) = -0.25 + (0, 058/2)(-1) = -0.28 В
ЭДС = -0, 28 – (-0, 308) = 0, 028 В
Процессы на электродах:
А: Ni0 - 2е- = Ni2+
К: Ni2++ 2е- = Ni0
|
|