
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пример. Будет ли взаимодействовать алюминий с раствором сульфата никеля?
|
|
Будет ли взаимодействовать алюминий с раствором сульфата никеля?
Решение: по таблице находим
e0Al+3/Al = -1.66В
е0Ni2+/Ni = - 0.25В
Потенциал Al меньше, следовательно, алюминий более сильный восстановитель, чем никель, от него электроны будут переходить к ионам никеля:
2Al + 3NiSO4 = Al2(SO4)3 + 3Ni
Фактически протекает реакция:
2Al0 + 3Ni2+ = 2Al+3 + 3Ni
Пример.
Цинк может вытеснять водород из растворов кислот, так как e0Zn2+/Zn равен -0, 76В и меньше, чем потенциал водорода.
Zn + 2HCl = ZnCl2 + H2
Zn – 2e- = Zn2+
2H+ + 2e- = H2
Медь не может вытеснять водород из растворов кислот, так как имеет потенциал +0, 34, больше нуля.
Электродный потенциал зависит от природы металла температуры, концентрации ионов металла в растворе. Эта зависимость выражается уравнением Нернста:

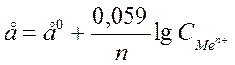 , где
, где
е0 –стандартный эдектродный потенциал;
n – число e-, принимающих участие в процессе;
СMen+ - концентрация ионов металла в растворе.
Из формулы следует, что чем больше разбавленный раствор, тем более отрицательно значение потенциала металла.
|
|