
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Произведение растворимости
|
|
Определение
Поместим в химический стакан какую-либо труднорастворимую соль, например, AgCl и добавим к осадку дистиллированной воды. При этом ионы Ag+ и Cl-, испытывая притяжение со стороны окружающих диполей воды, постепенно отрываются от кристаллов и переходят в раствор. Сталкиваясь в растворе, ионы Ag+ и Cl- образуют молекулы AgCl и осаждаются на поверхности кристаллов. Таким образом, в системе происходят два взаимно противоположных процесса, что приводит к динамическому равновесию, когда в единицу времени в раствор переходит столько же ионов Ag+ и Cl-, сколько их осаждается. Накопление ионов Ag+ и Cl- в растворе прекращается, получается насыщенный раствор. Следовательно, мы будем рассматривать систему, в которой имеется осадок труднорастворимой соли в соприкосновении с насыщенным раствором этой соли. При этом происходят два взаимно противоположных процесса:
1) Переход ионов из осадка в раствор. Скорость этого процесса можно считать постоянной при неизменной температуре: V1 = K1;
2) Осаждение ионов из раствора. Скорость этого процесса V2 зависит от концентрации ионов Ag+ и Cl-. По закону действия масс:
V2 = k2 • [Ag+] • [Cl-]
Так как данная система находится в состоянии равновесия, то
V1 = V2
k2 = k1 • [Ag+] • [Cl-]
[Ag+] • [Cl-] = k2 / k1 = const (при T = const)
Таким образом, произведение концентраций ионов в насыщенном растворе труднорастворимого электролита при постоянной температуре является постояннойвеличиной. Эта величина называется произведением растворимости (ПР).
В приведенном примере ПРAgCl = [Ag+] • [Cl-]. В тех случаях, когда электролит содержит два или несколько одинаковых ионов, концентрация этих ионов, при вычислении произведения растворимости должна быть возведена в соответствующую степень.
Например, ПРAg2S = [Ag+]2 • [S2-]; ПРPbI2 = [Pb2+] • [I-]2
В общем случае выражение произведения растворимости для электролита AmBn
ПРAmBn = [A]m [B]n.
Значения произведения растворимости для разных веществ различны.
Например, ПРCaCO3 = 4, 8 • 10-9; ПРAgCl = 1, 56 • 10-10.
ПР легко вычислить, зная раcтворимость соединения при данной t°.
Пример 1
Растворимость CaCO3 равна 0, 0069 или 6, 9 • 10-3 г/л. Найти ПРCaCO3.
Решение
Выразим растворимость в молях:
SCaCO3 = (6, 9 • 10-3) / 100, 09 = 6, 9 • 10-5 моль/л
MCaCO3
Так как каждая молекула CaCO3 дает при растворении по одному иону Ca2+ и CO32-, то
[Ca2+] = [ CO32-] = 6, 9 • 10-5 моль/л,
следовательно, ПРCaCO3 = [Ca2+] • [CO32-] = 6, 9 • 10–5 • 6, 9 • 10-5 = 4, 8 • 10-9
Зная величину ПР, можно в свою очередь вычислить растворимость вещества в моль/л или г/л.
Пример 2
Произведение растворимости ПРPbSO4 = 2, 2 • 10 -8 г/л.
Чему равна растворимость PbSO4?
Решение
Обозначим растворимость PbSO4 через X моль/л. Перейдя в раствор, X молей PbSO4 дадут X ионов Pb2+ и X ионов SO42-, т.е.:
[Pb2+] = [SO42-] = X
ПРPbSO4 = [Pb2+] = [SO42-] = X • X = X2
X = \é (ПРPbSO4) = \é (2, 2 • 10-8) = 1, 5 • 10-4 моль/л.
Чтобы перейти к растворимости, выраженной в г/л, найденную величину умножим на молекулярную массу, после чего получим:
1, 5 • 10-4 • 303, 2 = 4, 5 • 10-2 г/л.
Образование осадков
Если
[Ag+] • [Cl-] < ПРAgCl - ненасыщенный раствор
[Ag+] • [Cl-] = ПРAgCl - насыщенный раствор
[Ag+] • [Cl-] > ПРAgCl - перенасыщенный раствор
Осадок образуется в том случае, когда произведение концентраций ионов малорастворимого электролита превысит величину его произведения растворимости при данной температуре. Когда ионное произведение станет равным величине ПР, выпадение осадка прекращается. Зная объем и концентрацию смешиваемых растворов, можно рассчитать, будет ли выпадать осадок образующейся соли.
Пример 3
Выпадает ли осадок при смешении равных объемов 0, 2 M растворов Pb(NO3)2 и NaCl.
ПРPbCl2 = 2, 4 • 10-4.
Решение
При смешении объем раствора возрастает вдвое и концетрация каждого из веществ уменьшится вдвое, т.е. станет 0, 1 M или 1, 0 • 10-1моль/л. Таковы же будут концентрации Pb2+ и Cl-. Следовательно, [Pb2+] • [Cl-]2 = 1 • 10-1 • (1 • 10-1)2 = 1 • 10-3. Полученная величина превышает ПРPbCl2 (2, 4 • 10-4). Поэтому часть соли PbCl2 выпадает в осадок. Из всего сказанного выше можно сделать вывод о влиянии различных факторов на образование осадков.
Влияние концентрации растворов
Труднорастворимый электролит с достаточно большой величиной ПР нельзя осадить из разбавленных растворов. Например, осадокPbCl2 не будет выпадать при смешении равных объемов 0, 1 M растворов Pb(NO3)2 и NaCl. При смешивании равных объемов концентрации каждого из веществ станут 0, 1 / 2 = 0, 05 M или 5 • 10-2 моль/л. Ионное произведение [Pb2+] • [Cl1-]2 = 5 • 10-2 • (5 • 10-2)2 = 12, 5 • 10-5. Полученная величина меньше ПРPbCl2, следовательно выпадения осадка не произойдет.
Влияние количества осадителя
Для возможно более полного осаждения употребляют избыток осадителя.
Например, осаждаем соль BaCO3: BaCl2 + Na2CO3 ® BaCO3¯ + 2NaCl. После прибавления эквивалентного количества Na2CO3 в растворе остаются ионы Ba2+, концентрация которых обусловлена величиной ПР.
Повышение концентрации ионов CO32-, вызванное прибавлением избытка осадителя (Na2CO3), повлечет за собой соответственное уменьшение концентрации ионов Ba2+ в растворе, т.е. увеличит полноту осаждения этого иона.
Влияние одноименного иона
Растворимость труднорастворимых электролитов понижается в присутствии других сильных электролитов, имеющих одноименные ионы. Если к ненасыщенному раствору BaSO4 понемногу прибавлять раствор Na2SO4, то ионное произведение, которое было сначала меньше ПРBaSO4 (1, 1 • 10-10), постепенно достигнет ПР и превысит его. Начнется выпадение осадка.
Влияние температуры
ПР является постоянной величиной при постоянной температуре. С увеличением температуры ПР возрастает, поэтому осаждение лучше проводить из охлажденных растворов.
Растворение осадков
Правило произведения растворимости важно для переведения труднорастворимых осадков в раствор. Предположим, что надо растворить осадок BaСO3. Раствор, соприкасающийся с этим осадком, насыщен относительно BaСO3.
Это означает, что [Ba2+] • [CO32-] = ПРBaCO3.
Если добавить в раствор кислоту, то ионы H+ свяжут имеющиеся в растворе ионы CO32- в молекулы непрочной угольной кислоты:
2H+ + CO32- ® H2CO3 ® H2O + CO2
Вследствие этого резко снизится концентрация иона CO32- , ионное произведение станет меньше величины ПРBaCO3. Раствор окажется ненасыщенным относительно BaСO3 и часть осадка BaСO3 перейдет в раствор. При добавлении достаточного количества кислоты можно весь осадок перевести в раствор. Следовательно, растворение осадка начинается тогда, когда по какой-либо причине ионное произведение малорастворимого электролита становится меньше величины ПР. Для того, чтобы растворить осадок, в раствор вводят такой электролит, ионы которого могут образовывать малодиссоциированное соединение с одним из ионов труднорастворимого электролита. Этим объясняется растворение труднорастворимых гидроксидов в кислотах
Fe(OH)3 + 3HCl ® FeCl3 + 3H2O
Ионы OH- связываются в малодиссоциированные молекулы H2O.
Таблица. Произведение растворимости (ПР) и растворимость при 25°С некоторых малорастворимых веществ
| Формула | Растворимость | ПР моль / л |
| AgBr | 7, 94 • 10-7 | 6, 3 • 10-13 |
| AgCl | 1, 25 • 10-5 | 1, 56 • 10-10 |
| AgI | 1, 23 • 10-8 | 1, 5 • 10-16 |
| Ag2CrO4 | 1, 0 • 10-4 | 4, 05 • 10-12 |
| BaSO4 | 7, 94 • 10-7 | 6, 3 • 10-13 |
| CaCO3 | 6, 9 • 10-5 | 4, 8 • 10-9 |
| PbCl2 | 1, 02 • 10-2 | 1, 7 • 10-5 |
| PbSO4 | 1, 5 • 10-4 | 2, 2 • 10-8 |
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать(разделяться) обратимым образом на частицы, как например когда комплекс распадается на составляющиемолекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции
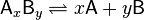
где комплекс 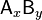 разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
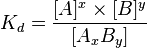
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Дробный анали з не предполагает предварительного разделения компонентов пробы.Ионы обнаруживают в отдельных порциях исследуемого раствора, добавляя соответствующие реагенты. Достоинства дробного анализа: качественные реакции на разные ионы можно проводить в любом порядке.анализ занимает немного времени. Недостатки дробного анализа: дробный анализ дает надежные результаты лишь при наличии специфических реакций на каждый предполагаемый компонент пробы.чем меньше селективность применяемых реакций и чем сложнее состав исследуемой смеси, тем больше ошибка результатов анализа. При использовании дробного анализа обнаружение иона выполняется в два этапа. На первом этапе устраняют влияние мешающих ионов в отдельных небольших порциях исследуемого раствора с помощью: удаления мешающих ионов; маскирования мешающих ионов: изменения рН, связывания мешающих ионов в комплексы, изменения степени окисления входящих в состав химических элементов. На втором этапе обнаруживают искомый ион соответствующей качественной реакцией. Пример: При анализе раствора, содержащего смесь ионов Аl3+, Сr3+, Zn2+ обнаружению катионов алюминия Аl3+ дробным методом мешают ионы цинка и хрома(III).1. На первом этапе дробного анализа необходимо удалить мешающие ионы. Для этого: - ионы Zn2+ связывают в растворимый комплекс при добавлении гексацианоферрата(II) калия K4[Fe(CN)6], - ионы Сr3+ окисляют до СrО4− действием пероксида водорода H2О2 в щелочной среде.2. На втором этапе, можно обнаружить ионы Аl3+ качественной реакцией с ализарином: Al3+ + Ализарин = Малиновое окрашивание
При систематическом анализе с помощью групповых реагентов из пробы сложного состава последовательно выделяют более простые по составу группы ионов.В зависимости от предполагаемого состава пробы используют разные способы разделения: Для анализа минералов, белков и некоторых других объектов применяют групповые реагенты-осадители. Нефтепродукты анализируют после их разгонки на фракции, различные по температуре кипения.Применяют сложные схемы экстракционного или сорбционного разделения.Для многих смесей эффективным способом является хроматографическое разделение компонентов. Схемы систематического анализа наиболее разрабо-таны для смесей катионов. Они предполагают применение групповых реагентов: кислот, щелочей, сероводорода, солей. Все катионы делят на аналитические группы в соответствии действием групповых реагентов.Возможный состав каждой группы известен заранее. Перед началом экспериментальных исследований проводят предварительные испытания. После проведения предварительных испытаний приступают к анализу раствора пробы систематическим методом. Схемы систематического анализа катионов: - сероводородная (ГР: HCl, H2S, (NH4)2S, (NН4)2СО3); - кислотно-щелочная (ГР: HCl, H2SО4, NН3, NaOH и др.), - аммиачно-фосфатная и др.
Общая характеристика катионов второй аналншческой группы. Их значение в тех но химическом контроле.
Ко второй аналитической группе катионов относятся ионы Ва2+, Са2+, Mg2+.Элементы этих катионов находятся во II группе главной подгруппе ПСXЭ. Гидроксиды бария Ва(ОН)2 и кальция Са(ОН)2 хорошо растворяются в воде, образуя щелочи. Гидроксид магния проявляет свойства слабого основания. Отличительной особенностью катионов второй группы от первой группы является то, что они образуют нерастворимые в воде карбонаты. Эти осадки хорошо растворимы в сильных кислотах HCl, НNO3 (кроме H2SO4) и в слабой уксусной кислоте СН3СООН. Следовательно, карбонат аммония (NН4)2СО3 может, быть групповым реактивом катионов второй группы только в нейтральной или в слобо-щелочной среде. Сульфиты катионов второй группы хорошо растворимы в воде. Этим они отличаются от катионов третьей и четвертой групп, сульфиды которых нерастворимы в воде. Сульфат магния MgSO4 в воде растворим, сульфат кальция CaSO4 мало растворим, сульфат бария ВaSO4 нерастворим в воде и сильных кислотах. Кислые соли катионов второй группы растворимы в воде. Катионы второй группы устойчивы к действию окислителей и восстановителей. Катионы Ва2+ и Са2+ бесцветны. Их летучие соединения окрашивают пламя газовой горелки в характерные цвета.
Катионы Са2+ и Mg2+ содержатся в молоке. В сыром молоке среднее содержание кальция 0, 12%. Молоко в продуктах питания определяют пo содержанию кальция. Реактивы катионов второй группы: хромат калия К2СrО4, оксалат аммония (NH4)2CО3, серная кислота H2SO4 - применяются при анализе продуктов питания.
|
|