
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Растворимость – способность вещества переходить в раствор под действием растворителя.
|
|
Количественно растворимость вещества оценивается содержанием растворенного вещества в его насыщенном растворе при данной температуре.
Количественное значение растворимости обычно выражают максимальной массой вещества в граммах, которую можно растворить в 100 г растворителя при данной температуре. Это количество называется коэффициентом растворимости или просто растворимостью (S).
В зависимости от величины коэффициента растворимости все вещества подразделяются на:
хорошо растворимые (коэффициент растворимости S > I г в 100 г растворителя), например KI, AgNO3,
малорастворимые (10–3 г < S < I г в 100 г растворителя), например, Mg(ОH)2, СаSО4, СН4, N2, O2,
практически нерастворимые (коэффициент растворимости S < < 10–3 г в 100 г растворителя), например Аg, BaSO4, стекло.
Абсолютно нерастворимых веществ не существует.
Растворимость газов в жидкости зависит от природы растворяемого вещества и растворителя, температуры и давления. Растворимость жидких и твёрдых веществ — от давления практически не зависит.
В настоящее время для выражения количественного состава растворов используются различные способы. Наиболее часто используются следующие:
1. Концентрированный раствор – раствор, содержащий относительно большое количество растворенного вещества. В этом случае масса растворенного вещества соизмерима с массой растворителя.
Например, в 100 г воды растворено 30 г хлорида натрия (30 г и 100 г – сравнимые величины). Такой раствор можно считать концентрированным.
2. Разбавленный раствор – это раствор, в котором содержание растворенного вещества мало по сравнению с массой растворителя.
Например, в 100 г воды растворено 0, 1 г гидроксида натрия. Это разбавленный раствор, так как массы растворенного вещества и растворителя сильно отличаются друг от друга.
Термины концентрированный и разбавленный используются лишь для приблизительного выражения количественного состава растворов. Границы между этими понятиями достаточно условны.
Для точного выражения количественного состава растворов используют следующие способы:
· Массовая доля (ранее использовался термин «процентная концентрация»).
Массовая доля показывает отношение массы данного компонента, содержащегося в системе (растворе), к общей массе этой системы (раствора).
Обычно массовая доля выражается в долях единицы или процентах и обозначается греческой буквой ω (омега):
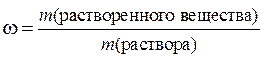 ;
;
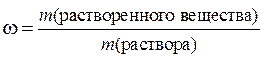 100 %.
100 %.
При выражении массовой доли раствора (в процентах), ее значение показывает массурастворенного вещества (в граммах), содержащееся в 100 г раствора.
Например, раствор с массовой долей KNO3 равной 24 % содержит в растворе массой 100 г: растворенное вещество (нитрат калия) массой 24 г и растворитель (воду) массой (100 – 24) = 76 г.
· Объемная доля.
Этот способ выражения количественного состава представляет собой отношение объема компонента (растворенного вещества), содержащегося в системе (растворе), к общему объему системы (раствора). Объемная доля выражается либо в долях единицы, либо в процентах и обозначается греческой буквой j (фи).
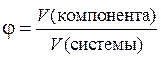 ,
,
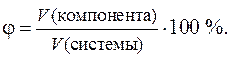
При выражении объемной доли (в процентах) ее значение показывает объем растворенного вещества (в соответствующих единицах объема), содержащийся в 100аналогичных единицах объема раствора.
· Мольная (молярная) доля.
Этот способ выражения количественного состава растворов представляет собой отношение количества вещества (в молях) компонента, содержащегося в данной системе, к сумме количеств всех веществ в системе. Выражается в долях единицы, либо в процентах и обозначается греческой буквой 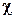 (хи):
(хи):
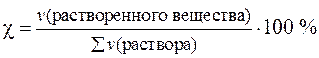
где ν – количество вещества в молях, ∑ ν (раствора) – сумма количеств всех веществ в растворе.
Например, раствор с мольной долей c = 2 % этанола содержит 2 моль этанола на 100 моль системы (2 моль этанола и 98 моль воды).
Если для количественной оценки состава раствора используют отношение массы вещества (m) или его количества (ν) к общему объему раствора (V), то применяют понятие «концентрация» (С).
· Массовая концентрация.
|
|