
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Розпад збуджених і нестійких ядер
|
|
Так само, як атом може існувати в будь-якому ряді збуджених станів, так само ядро може перебувати в широкому наборі дискретних, проквантованих, збуджених станів ядра. Поведінка ядер в перетворені до більш стійких станів певною мірою подібна до перетворення атомів від збудженого до більш стійкого стану, але є деякі важливі відмінності.
1) набагато більша відмінність енергетичних рівнів;
2) тривалість часу перебування ядра в збудженому стані – від 10-4 секунди до 1011 років, тоді як час перебування в збудженому стані атому зазвичай близький до 10-8 секунди;
3) збуджені атоми випускають фотони, а збуджені ядра можуть випустити крім фотонів і інші частки.
Фотон, який випускається при розпаді нестійких ядер, іменується гамма-променем. Ядерні реакції повинні підпадати під дію загальних законів фізики – збереження імпульсу (інерції), збереження маси і енергії, збереження спіну тощо, а також збереження ядерних часток. Крім розпаду збудженого ядра до більш стійкого стану, для нестійких ядер можливий і розпад, завдяки емісії чи приєднанню часток з ненульовою масою, до цілком відмінного ядра.
Ядерний розпад відбувається з швидкістю, яка відповідає закону радіоактивного розпаду. Цікаво, що швидкість розпаду залежить лише від природи та енергетичного стану нукліду. Вона не залежить від минулої історії ядра і, по суті, незалежна від зовнішніх впливів, таких як, наприклад, температура, тиск тощо. Однією з особливостей є неможливість передбачення часу розпаду конкретного ядра. Можливо лише передбачити ймовірність розпаду в даному інтервалі часу. Ймовірність розпаду ядра в деякому безкінечно малому інтервалі часу, dt, є l, як зазвичай позначають постійну розпаду (розмірність – років-1). Ймовірність розпаду деякої кількості ядер N за проміжок часу dt дорівнює l× N. Таким чином, швидкість розпаду N нуклідів можна оцінити за формулою:
| dN/dt =-l× N | 8.4 |
Знак “-” просто вказує на зменшення кількості N з часом. Рівняння 8.4 є основоположним законом, і його іменують Основним Рівнянням Радіоактивного Розпаду. Це рівняння за значенням подібне до рівняння рівноваги хімічних реакції, а l, за значенням, відповідає константі рівноваги реакцій, з тією відмінністю що постійна розпаду не залежить від всіх інших чинників.
Радіоактивний процес є статистичним, тому період напіврозпаду (яким звичайно характеризують радіоактивні елементи) є справедливим для великої кількості розпадів. Періоди напіврозпаду відомих радіоактивних елементів складають від 10-9 до 1022 років. При цьому цей інтервал визначається нинішніми технічними можливостями, тож можливо що елементи, які ми нині відносимо до стабільних, врешті виявляться радіоактивними з великим періодом розпаду – і тоді підтвердяться слова Вернадського “бренность есть свойство всех элементов”. Адже по сьогодні нема пояснень причин радіоактивності – нестабільність, енергетична невигідність певних ізотопів з відповідними кількостями і співвідношеннями нейтронів і протонів відома, але чому, наприклад, ядро атому 92146U238 має період піврозпаду саме 4, 47× 109 років, що змушує його розпадатися після мільярдів років існування?
Гамма-розпад
Випромінювання гамма-квантів відбувається тоді, коли збуджене ядро розпадається для здійснення переходу до більш стійкого стану. Гамма-промінь є просто фотоном з високою енергією (тобто, електромагнітне випромінювання). Частота цього випромінювання, n, пов’язана з різницею енергій рівнянням:
| h× n=Eu - El | 8.5 |
де Eu і El є енергіями верхнього (збуджений) і нижнього (основний) станів, а h є постійною Планка (Planck’s). Відповідна ядерна реакція, враховуючи відсутність зміни масового числа, кількості протонів і нейтронів, записується так:
| AZ* -> AZ+g | 8.6 |
де Z - символ елемента, A - масове число, а символом g позначається гамма-промінь.
Альфа-розпад
Альфа-частка є просто ядром гелію. Оскільки ядро гелію особливо стійке, то було б не дивним, якби така група часток існувала всередині батьківського ядра перед a -розпадом. Емісія альфа-частки зменшує масу ядра на масу ядра гелію плюс масовий еквівалент енергії, що витрачається під час розпаду. Витрачена енергія включає:
- кінетичну енергію альфа-частки (постійна для будь-якого даного розпаду);
- кінетичну енергію залишкового ядра (згідно закону збереження імпульсу, на залишкове ядро поширюється ефект віддачі від реакції розпаду);
- енергію будь-якого випущеного гамма-променю.
ZXA ® Z-2XA-4+ 2He4 + g
Випуск a-частки є достатньо складним процесом, оскільки вона (частка) повинна подолати дуже суттєвий енергетичний бар’єр, який є комбінацію сильної взаємодії і електростатичного відштовхування. Наприклад, ядрами 238U повинні випромінюватись a-частки з енергіями дещо нижче 8 Мев. Однак, при розпаданні 238U появляється a-частка з енергією лише близько 4 МеВ. Це є прикладом прояву тунельного квантового механічного ефекту, який можна пояснити наступним чином. Квантова механіка вважає що ми ніколи не можемо точно знати місце знаходження a-частки (або будь-якої іншої частки), ми знаємо тільки вірогідність її існування в специфічному місці. Ця ймовірність визначається квадратом хвилевої функції частки, y. Хоча ця хвиля різко згасає при проходженні потенціального енергетичного бар’єру енергії, вона все ж має малу, але не рівну 0 амплітуду за межами ядра, отож є мала, але не рівна нулю, ймовірність випуску a-частки яка розміщувалась поза ядром. Будь-що, що може відбутися, зрештою відбудеться і рано чи пізно альфа-частка покине ядро.
Дочірнє ядро може спочатку перебувати в збудженому стані, з якого здійснює перехід до основного стану завдяки гамма-розпаду. Альфа-розпад Альфи відбувається в ядрах з масами вищими за максимумом на кривій питомої енергії зв’язку, тобто за 56Fe. Цілком можливо, всі такі ядра є нестійкими і здатним на альфа-розпад, але періоди піврозпаду більшості з них дуже великі.
Бета-розпад
Бета-розпад є процесом, при якому змінюється заряд (кількість протонів) ядра, але не кількість нуклонів загалом (масове число).
Бета-розпад відбувається за рахунок сил слабкої ядерної взаємодії. Слабкі взаємодії перетворюють нейтральну частку в заряджену і навпаки. Вважають, що і сила слабкої взаємодії і електромагнітна сила є просто проявами однієї сили, яка обумовлює всі взаємодії пов’язані з зарядом (в тому ж сенсі, що електричні і магнітні сили є проявами електромагнетизму), названої електрослабкою (electroweak). При позитронному розпаді, наприклад протон, позбавляючись одиниці заряду, перетворюється в нейтрон, випускаючи при цьому одночасно позитрон і нейтрино (вони взаємопов’язані, час існування b-активних ядер оцінюється приблизно в 103 с). Цей процес відбувається через проміжні частки W+ таким же чином, що й і електромагнітні процеси, для яких посередником є фотон. Фотон, піон і частки W є члени класу часток які називають бозонами, часток які забезпечують зв’язок між основними складовими процесів. При цьому W-частки і піони, на відміну від фотонів, мають масу інерції.
Захоплення електрону
Іншим типом реакції є захоплення електрону. Це відмінний різновид бета-розпаду, ефект якого приблизно ідентичний позитронному бета-розпаду. Цікавим є те, що в даному випадку електрон додається до ядра яке розпадається, в результаті чого маса новоутвореного ядра менша ніж у батьківського! Різниця мас витрачається на енергію нейтрино та, в деяких випадках, гамма-квантів. В деяких випадках, ядро може розпадатися або захопленням електрону, або з емісією позитрону чи електрону. Наприклад: при розпаді 40K, може відбутися позитронний розпад або захоплення електрону, в результаті чого утвориться 40Ar, або – електронний розпад, що призведе до утворення 40Ca. Ми вже з’ясовували (Приклад 8.1 Вайта), що 50V менш стійкий, ніж його 2 ізобари: 50Cr і 50Ti. Фактично це означає, що атом 50V зрештою розпадеться або до атому 50Cr (електронний розпад) або до 50Ti (захоплення електрону). Період напіврозпаду в даному випадку 1, 4× 1017 років, так що розпад будь-якого окремого атому 50V є достатньо неймовірним.
Електронний розпад і захоплення електрону часто залишають дочірнє ядро в збудженому стані. В такому випадку, це призведе (і зазвичай дуже швидко) до розпаду з випуском гамма-квантів. Таким чином, гамма-промені є звичайним супутником бета-розпаду. Зміни в ядрі вимагають певних змін (переміщень) на електронних орбітах, які супроводжуються випусканням рентгенівських променів (джерелом в даному випадку є електрони на внутрішніх орбітах).
Безпосереднє (спонтанне) розщеплення
Розщеплення є процесом при якому ядро фактично розколюється на два (або більше) важкі дочірні ядра. В природі такі процеси є дуже рідкісними, вони відбуваються тільки в найважчих ядрах, 238U, 235U, і 232Th (найбільш вірогідно це для 238U). Таке специфічне явище, можливо, краще пояснювати за допомогою моделі краплі рідини, а не оболонковою. У моделі краплі рідини поверхневе напруження намагається мінімізувати зовнішню область, в той час, як кулонівська енергія відштовхування спрямована на збільшення об’єму (і зовнішньої поверхні) ядра. Форма ядра може настільки змінитися (деформуватися) під дією 90 чи більше протонів, що поверхнева енергія не зможе відновити форму, і спрямованість до мінімізації поверхневої енергії буде реалізована шляхом поділу ядра. Оскільки існує тенденція збільшення співвідношення N/Z (для забезпечення стійкості ядра при великій кількості нуклонів), батьківське ядро збагачене нейтронами. При розчепленні ядра утворюються нестійкі багаті нейтронами дочірні ядерні фрагменти (з зарядами від 30 - Zn до 65 - Tb) та вільні нейтрони. Дочірні ядра негайно продовжать розпад (емісія електронів, з перетворенням нейтронів на протони), і будуть розпадатися до того моменту коли буде досягнуте енергетично стабільне співвідношення між протонами і нейтронами (одним із звичайних продуктів поділу урану є ксенон). Саме ця тенденція до вироблення нестійких продуктів розпаду робить такими небезпечними (з погляду радіоактивного випромінювання) реакції розщеплення в бомбах і ядерних реакторах (активність продуктів розпаду значно вища ніж безпосереднє випромінювання при розчепленні).
Деякі нестійкі і збуджені важкі ядра особливо схильні до розщеплення. Важливим прикладом є 236U. Уявіть собі матеріал багатий на U. Коли один атом 238U зазнає розщеплення, деякі звільнені нейтрони захоплюються ядрами 235U і утворюються збуджені ядра 236U. Ці ядра 236U потім розщеплюються і продукують більшу кількість нейтронів, і так далі. Така, ланцюгова, реакція є основною для ядерних реакторів і бомб (в дійсності, щоправда, тепер частіше використовують деякі інші ядра, наприклад Pu).
На щастя, концентрація U в природі не настільки висока щоб забезпечити подібні реакції. Але, хоча б одного разу, подібна концентрація елементів була утворена. Загально відомим є феномен природного ядерного реактора в Окло (Oklo - уранове родовище в Габоні, західна Африка). За існуючими даними тут близько 2 млрд. років тому почалась природна ланцюгова ядерна реакція, яка продовжувалась з різною інтенсивністю близько 500 тисяч років. В результаті на 50% зменшилась кількість 92U235 (на всіх відомих уранових родовищах співвідношення 92U238: 92U235 є стабільним). За деякими оцінками тут " вигоріло" близько 500 кг 92U235. Тут же знайдено й продукти ланцюгової реакції - ізотопи Xe, Nd, Sm, Ru.
Індивідуальні реакції розщеплення менш рідкісні. Коли розщеплення відбувається виробляється певна кількість кінетичної енергії, і утворені фрагменти розлітаються в прямому значенні цього слова. Ці фрагменти пошкоджують структуру кристалів, через які проходять, залишаючи сліди, які можна краще бачити при протравленні. Це явище є основою запізнілого трекового датування.
Природне розщеплення також може спровокувати зміни поширеності ізотопів дочірніх елементів. Хоча, на загал, кількість утворених в результаті розчеплення ізотопів настільки мала відносно загальної кількості елементів в Землі, що зміни ізотопного складу дуже малі. Важливим винятком є ксенон, чий ізотопний склад може дещо змінитися завдяки розщепленню U і щезлого нині 244Pu.
Природних довго живучих ізотопів відомо близько 20, найважливішими (за розповсюдженістю в земній корі) з них є: 37Rb87, 90Th232 (T1/2 = 1, 4× 1010 років), 92U238 (T1/2 = 4, 47× 109 років), 19K40 (T1/2 = 1, 28× 109 років), 92U235 (T1/2 = 7, 07× 108 років).
За час існування Землі кількість радіоактивних ізотопів суттєво зменшилась (19K40 – в 12 разів, 92U235 – в 30 разів тощо).
92U235, 92U238, 90Th232 є представниками трьох рядів розпаду (актиноурану, урану і торію), кінцевими продуктами розпаду яких є (для всіх трьох) стабільні ізотопи:
| 92U238 | Þ | 82Pb206 та 8*2He4 + 6b | парно-парний |
| 92U235 | Þ | 82Pb207 та 7*2He4 + 5b | парно-непарний |
| 90Th232 | Þ | 82Pb208 та 6*2He4+ 4b | парно-парний |
Можливо що в минулому існував і четвертий ряд розпаду - ряд 93Np237 (T1/2 = 2, 25*106 років). Якщо це дійсно так, то існуючий стабільний (T1/2 близько = 1018 років, альфа розпад до 81Tl205) ізотоп вісмуту 83Bi209 є кінцевим продуктом цього розпаду.
| 93Np 237 | Þ | 83Bi209 та 8*2He4+ 4b | непарно-парний |
Проміжні продукти розпаду різноманітні і представлені переважно короткоживучими ізотопами. Наприклад, при розпаді 92U238 утворюються ізотопи Pa, Th, Ra, Rn, At, Bi і т.д.
| Основний закон радіоактивного розпаду: N = N0 × e- lt; де N0 – кількість радіоактивних ядер при t =0, а l - постійна розпаду. При цьому l пов’язане з періодом піврозпаду Т наступним співвідношенням Т= ln2/ l= 0.693/l |
8. Стабільні ізотопи в геохімії.
Відомо близько 300 (276 в таблиці 6.1) стабільних ізотопів та понад 1200 радіоактивних
Хімічні відмінності ізотопів залежать від їх термодинамічних властивостей. Найбільшу роль в розділенні ізотопів відіграють процеси випаровування, фізичної абсорбіції, розчинення, плавлення і кристалізації.
Згідно Й.Хефса (Hoefs, J. Stable Isotope Geochemistry. 3rd ed. Berlin: Springer-Verlag, 1988) існує три загальні правила фракціонування ізотопів:
1. Відчутне фракціонування спостерігається для елементів з А£ 40 (тобто до кальцію) і, вірогідно, для селену (фракціонування ізотопів 76Se і 82Se має бути подібним із спостереженим для ізотопів сірки).
2. У елементів, які утворюють тверді, рідкі та газоподібні сполуки, важкі ізотопи зазвичай накопичуються в твердій фазі, а також в молекулах, де елементи знаходяться в найбільш окисленому стані.
3. В більшості біологічних систем легкі ізотопи звичайно накопичуються в продуктах реакції, наприклад фотосинтезу.
В таблиці 2 показана відносна поширеність деяких ізотопів
Таблиця 6.4 - Відносна поширеність деяких стабільних ізотопів
| Ізотоп | Відносна поширеність, % | Ізотоп | Відносна поширеність, % | Ізотоп | Відносна поширеність, % | Ізотоп | Відносна поширеність, % | Ізотоп | Відносна поширеність, % |
| 1H | 99, 9844-99, 987 | 12C | 98, 893 | 24Mg | 78, 79 | 32S | 95, 02 | 40Ca | 96, 67 |
| 2D | 0, 013-0, 0156 | 13C | 1, 107 | 25Mg | 10, 15 | 33S | 0, 75 | 42Ca | 0, 64 |
| 6Li | 7, 52 | 14N | 99, 64 | 26Mg | 11, 06 | 34S | 4, 21 | 43Ca | 0, 145 |
| 7Li | 92, 48 | 15N | 0, 36 | 28Si | 92, 27 | 36S | 0, 02 | 44Ca | 2, 06 |
| 10B | 18, 98 | 16O | 99, 7630 | 29Si | 4, 68 | 39K | 93, 10 | 46Ca | 0, 0033 |
| 11B | 81, 02 | 17O | 0, 0375 | 30Si | 3, 05 | 41K | 6, 88 | 48Ca | 0, 185 |
| 18O | 0, 1995 |
Для того щоб елемент використовувався в ізотопній геохімії він має задовольняти наступним вимогам:
(1) мала атомна маса;
(2) відмінність мас між ізотопами відносно велика (бажано понад 5%);
(3) формує ковалентні зв’язки;
(4) існує в більш ніж одній валентності, яка відповідає ступеню окиснення (C, N і S), або входить до складу великої кількості різноманітних сполук (O), або є важливою складовою частиною поширених природних твердих тіл та розчинів.
(5) поширеність рідкісного ізотопу є достатньо високою (бажано не менш як 0, 1%) – для полегшення вивчення.
Цікаві для геохімії радіоактивних ізотопів елементи (Sr, Nd, Hf, Os, Pb), як правило:
· мають велику масу;
· формують переважно іонні зв’язки;
· існують лише в одній валентності, яка відповідає ступеню окиснення;
· відмінність мас ізотопів складає лише частки відсотка
Таким чином фракціонування ізотопів цих елементів дуже незначне і може ігноруватися.
Таблиця 3 – Ізотопні співвідношення в деяких стандартних зразках
| Елемент | Параметр | Відношення | Назва стандарту | Абсолютна величина співвідношення |
| Водень | dD | D/H (2H/1H) | SMOW (стандартна океанічна вода) | 1, 557*10-4 |
| Літій | d6Li | 6Li/7Li | NBSL-SVEC | 0, 08306 |
| Бром | d11B | 11B/10B | NBS951 | 4, 044 |
| Вуглець | d13C | 13C/12C | PDB (карбонат белемніту з крейдової формації Піді – США) | 1, 122*10-2 |
| Азот | d15N | 15N/14N | стандартна атмосфера | 3, 613*10-3 |
| Кисень | d18O | 18O/16O | SMOW, PDB | 2, 0052*10-3 |
| d17O | 17O/16O | SMOW | 3, 76*10-4 | |
| Сірка | d34S | 34S/32S | CDT (троїліт з метеориту Каньйон-Дьябло) | 4, 43*10-2 |
Застосування геохімії стабільних ізотопів дуже різноманітні:
· геотермометрія;
· ідентифікація процесів (одні рослини продукують вуглеводневі ланцюжки С4, а інші - С3. Для цих типів з’єднань характерне відмінне фракціонування ізотопів, а оскільки вони зберігаються в харчовому ланцюгу, то за ізотопним складом зкам’янілих решток можна робити певні висновки щодо раціону тварин)
· відстеження процесів (стабільні ізотопи як мічені атоми). Так, наприклад, ми можемо використовувати відношення ізотопів кисню в вулканічних породах для визначення – асимілювали вони матеріал земної кори чи ні (в корі інше співвідношення ізотопів ніж в мантії).
9. Сучасна геохімічна класифікація елементів.
На сьогодні при практичних геохімічних дослідженнях найчастіше використовується геохімічна класифікація елементів відкоригована класифікація Гольдшмідта, яка будується на таких принципах:
Літофільні елементи - це елементи гірських порід. На зовнішній оболонці їх іонів знаходиться 2 або 8 електронів, на кривій атомних об’ємів вони розташовуються на вершинах і ділянках спаду. Теплота утворення їх окислів більша, ніж у FeO (D Hf, 298° = -263, 68 кДж/моль = - 63, 2 ккал/моль). А різниця теплот - міра літофільності. Літофільні елементи важко відновлюються до елементарного стану. Звичайно вони зв'язані з О і складають основну масу силікатів і алюмосилікатів. Зустрічаються також у виді окислів, фосфатів, сульфатів, боратів, карбонатів і галогенідів. Літофільні елементи переважно парамагнітні, мають високі від’ємні значення стандартних потенціалів (Eh): Li/Li+= -3, 01, K/K+= -2, 92, Са/Са2+= -2, 84, Na/Na+= -2, 71, Mg/Mg2+= -2, 38 і т.д.
В.В.Щербина [1971р.] до літофільних відносить 54 елементи: лужні і лужноземельні, B, Al, Sc, лантаноїди й актиноїди, С, Si, Ti, Zr, Hf, P, V, Nb, Та, O, Cr, W, галогени, Mn, можливо Ті.
Таблиця 6.4 - Геохімічна класифікація елементів по В. М. Гольдшмідту з доповненнями В. В. Щербини
| Групи, елементи | Будова іону | Розташування на кривих атомних об’ємів | Магнітні властивості | Специфічна хімічна спорідненість | Інші властивості |
| Атмофільні.Н, Не, N, Ne, Ar, Kr, Xe, Rn. | У більшості випадків знаходяться у виді неіонізованих дискретних атомів і молекул. | На ділянках максимальних значень | Більшість діамагнітні | Звичайно зустрічаються в природі як прості тіла (елементи) | Характерний газоподібний стан |
| ЛітофільніLi, Be, B, С, O, F, Na, Mg, Al, Si, P, (S), Cl, K, Ca, Se, Ti, V, Cr, Mn, Br, Rb, Sr, Y, Zr, Nb, I, Cs, Ba, TR, Hf, Та, W, Ra, U, Th | Іони побудовані по моделі атома благородних газів, зовнішня оболонка з 8 електронів (2s і 6р) | На убутних гілках | Парамагнитны | Спорідненість до O, F, Cl | Щільність окислів порівняно невисока |
| XалькофільніS, Cu, Zn, Ga, Ge, As, Se, Pd, Ag, Cd, In, Sn, Sb, Ті, Au, Hg, Ti, Pb, Bi, (Po?) | Іони побудовані по моделі атома благородних газів, зовнішня оболонка з 18 електронів (2s, 6р і 10d) за винятком S, Se, Ті, As, Sb | На зростаючих гілках | Діамагнітні. Діамагнетизм у межах кожної групи періодичної системи зростає з порядковим номером. | Спорідненість до S, Se, Ті | Розплавлені сульфіди розчинні в розплаві FeS. Утворюють комплексні сульфіди |
| СидерофільніFe, Co, Ni, Мо, Тc, Ru, Rh, Os, Ir, Pt, P (?) | Іони перехідного типу з числом електронів у зовнішній оболонці від 8 до 18 | На ділянках мінімальних значень | Феромагнітні і парамагнітні | Спорідненість до С, Р, As, (Sb) | Велика густина. Часто зустрічаються в самородному стані |
Халькофільні елементи - це елементи сульфідних руд. На зовнішній оболонці їх іонів розташовується по 8 (S, Se, Ті) або 18 (в інших) електронів. Вони розташовуються на висхідних ділянках кривих атомних об’ємів. Теплота їх утворення нижче, ніж у FeO (для FeS2 D Hf, 298° = -177, 4, для HgS -58, 16, для PbS -94, 28, для Ag2S -33, 2 кДж/моль і т.д.). Вони діамагнітні, мають негативні значення стандартних потенціалів, але менші, ніж у літофільних елементів (Zn/Zn2+=-0, 766, Pb/Pb2+= -0, 13 В і т. д.). У природі зустрічаються у вигляді сульфідів, селенідів, телуридів, а також у самородному стані (Cu, Ag, Hg, Pb, Zn, As, Sb, Bi, S, Se, Ті, Sn). Крім названих до халькофільних елементів належать Ca, Ge, Cd, In, Tl, Po - всього 18 елементів.
Сидерофільні - це елементи в яких добудовуються електронні оболонки d і f. Сюди належать всі елементи VIII групи періодичної системи, а також Mo, Ті, Re і Аu — всього 13 елементів. Сидерофільні елементи займають мінімуми кривих атомних об’ємів. Частина окислів мають теплоту утворення, близьку до FeO (для NiO D Hf, 298° = -239, 7 кДж/моль), більшість же з них хімічно інертні і тому зустрічаються в самородному стані.
Сидерофільні елементи феромагнітні і парамагнітні. Електродні потенціали негативні (Fe/Fe2+= -0, 44, Ni/Ni2+=- 0, 23 В), у золота Au/Au3+=+l, 4 В. Виявляють специфічну спорідненість до As і S [PtAs2, FeAs2, NiAs2, (Fe, Ni)S, MoS2, CoAs тощо], а також до P, С, N. Майже всі сидерофільні елементи, крім того, зустрічаються в самородному стані.
Атмофільні елементи – це елементи атмосфери. Більшість із них має атоми з заповненими електронними оболонками - це інертні гази Не, Ne, Ar, Kr, Xe, Rn, а також N і H. На кривих атомних об’ємів атмофільні елементи розташовуються на висхідних гілках. Переважно діамагнітні. Внаслідок високих потенціалів іонізації важко вступають у з'єднання з іншими елементами і тому в природі знаходяться (крім H) головним чином в елементарному (самородному) стані.
Біофільні елементи - це елементи які відіграють велику роль в будові живої речовини (в першу чергу C, H, O, N, P, S, Cl, I, а також, певною мірою - B, Ca, Mg, K, Na, V, Mn, Fe, Cu) і детально розглядатимуться далі.
HFS
LIL
10. Закриті та відкриті геохімічні системи, параметри їх стану. Компоненти природних систем. Концентрація та активність, їх співвідношення для макро- та мікрокомпонентів. Рівноважний, ефективний та комбінований коефіцієнти розподілу елементів, методи їх визначення.
Залежно від характеру взаємодії систем з довкіллям розрізняються: а) ізольовані системи, які оточені жорсткою оболонкою, не проникною тепло і речовина; б) закриті системи, які можуть обмінюватися з довкіллям теплом і роботою, але маса їх залишається постійною; у) відкриті системи, які можуть обмінюватися з довкіллям теплом, роботою і компонентамі, що складають систему.
Параметри стану:
- теплових процесів – температура, ентропія, теплова робота;
- механічних процесів – тиск, об’єм, механічна робота;
- хімічних процесів – маса, хімічний потенціал, хімічна робота.
При рівновазі вільна енергія закритої системи є мінімальною, а DG =0. Саме ця умова є критерієм рівноваги.
К природних системах виділяють такі компоненти: інертні – для яких фактори стану є екстенсивні параметри; цілком рухомі, для яхих фактором стану є інтенсивні параметри; віртуальні компоненти – не впливають на стан системи.
Ступінь захоплення кристалізуючимся мінералом будь-якого елементу можна виразити за допомогою коефіцієнта розподілу (k). Цей коефіцієнт відображає відношення масової концентрації елементу (M) в мінералі до його вмісту в магмі.
| kM=[M] в мінералі / [M] в магмі |
Значення kM може бути дуже чутливим до змін температури, тиску і складу мінералів та магми під час кристалізації (для розсіяних елементів спостерігається залежність від температури, тиску і концентрації головних елементів).
Наприклад, залежність від температури описується рівнянням типу:
| lnk=A*1000/T +B |
де A і B є константами (A> +1, B – найчастіше достатньо велике від’ємне число і лише зрідка наближається до 0), а T – температура в кельвінах (наприклад коефіцієнт розподілу для стронцію в парі плагіоклаз - базальтовий розплав визначений як lnkSrPl=15121/T-9, 909). Тобто з ростом температури коефіцієнт розподілу, як правило, зменшується (хоча інколи – самарій в гранаті, зростає).
Залежності коефіцієнт розподілу від складу вивчені ще недостатньо, однак відомо що розподіл нікелю в системі олівін-розплав залежить від вмісту магнію, розподіл марганцю – від відношення Si/O.
Існує тенденція до зростання коефіцієнтів розподілу при переході від основних порід до кислих.
Для цілей петрогенетичного моделювання часто використовують валовий коефіцієнт розподілу. Так, за одночасної кристалізації мінералів Q, R і S (в пропорціях a, b і g, при a+b+g=1):
Будь який з коефіцієнтів є справедливим виключно за даних тиску і температури та рівноважного розподілу елементу між фазами.
Неідеальні розчини описуються наступним чином
μ i= μ 0i +RTln ai
де аі – активність і-ї речовини
μ 0i – хімічний потенціал компоненту і в розчині
ai=γ ixi
де, γ i – коефіцієнт активності.
Коефіціент активності може розглядатись як міра ступеню відхилення від не ідеальності.
У випадку розбавленого розчину активність розчиненого компоненту може бути прийнятим пропорційній мольній частці:
аі=knxi
Дане співвідношення є законом Генрі, де kn – константа пропорційності (константа Генрі).
Поведінка мікроелементів в магматичних системах підкорюється закону Генрі.
Один з способів з допомогою якого може бути виміряни вплив зміни складу багатокомпонентної системи на активність одного компоненту
11. Хондритнормалізовані графіки та їх використання для інтерпретації розподілу рідкісноземельних елементів, зокрема полівалентних.
Хондрит нормалізовані графіки – це графіки в яких нормується вміст р.з.е. у породі до їх вмісту у вуглистих хондритах. Деплетована мантія буде мати нижчий вміст рідкісних елементів ніж не деплетована.
12. Поняття про структурний, термодинамічний та кінетичний фактори контролю розподілу елементів в геологічних об’єктах.
Процеси хімічного фракціонування в кристалізуючійся магмі, незалежно від рівноважності чи нерівноважності умов, в поєднанні з протилежними процесами часткового плавлення материнських гірських порід призводять до розмаїття складів магм і широкому діапазону фракціонування великої кількості елементів. Метаморфізм та гіпергенні процеси не можуть обумовити такого ж масштабного фракціонування, однак вони можуть суттєво перерозподілити елементи в межах невеликих об’ємів гірських порід: в результаті росту нових мінералів, розчинення або перекристалізації. Тому важливим є розуміння контролюючого впливу на розподіл елементів в породах структури – структури розчинів, розплавів і твердих фаз. Молекулярна структура відображає спосіб заповнення і взаємне розташування атомів в хімічній сполуці і найважливіший вплив на неї мають розміри атомів, що входять до складу сполуки. Чинником, який впливає на впорядкованість кристалічної структури, є також природа хімічного зв’язку. Зокрема, в іонних твердих тілах важливе значення мають заряди іонів, оскільки їх взаємна локальна нейтралізація в кристалі та ефекти відштовхування допомагають визначити розташування в решітці іонів однакового знаку. У твердих тілах з ковалентним зв’язком важливим чинником є геометрична конфігурація локалізованого в просторі розподілу узагальнених атомами електронів.
Термодинамічний контроль полягає у залежності міграції хімічних елементів при різних умовах температури, тиску і їх концентрації. При вивченні термодинамічного розподілу елементів важливими є термодинамічні параметри: енергія Гіббса, ентальпія, ентропія, активність і склад, константа рівноваги, розподіл елементів між фазами і тд..
Кінетичний еонтроль розпділу хімічних елементів. Процеси утворення магматичних і метаморфічних порід, що включає переніс хімічних речовин в діапазоні від атомного рівня, як прои рості кристалів і дифузії, до руху великої маси речовини, як при впровадженні магми. У всьому цьому діапазоні характер, швидкість і тривалість процесів утворення порд пливають на кінцевий хімічний склад продуктів процесу.
13. Структура силікатних розплавів. Зв’язок ступеню їх полімерізації та поведінки елементів в процесі кристалізації магм.
Як і в силікатних мінералах, первинним структурним елементом силікатних розплавів є кременекисневий тетраедр, який складається з атома кремнію, що оточений чотирма атомами кисню. Як і в силікатних мінералах, тетраедри можуть бути поєднані спільними атомами кисню, які називають містковими (тобто кожен атом кисню пов’язаний з 2 атомами кремнію і формує місткові з’єднання). Відповідно, атоми кисню, що не є спільними називаються немістковими. Роз’єднані тетраедри кремнезему, в яких відсутні кисневі місткові з’єднання, називаються мономірами, - SiO44- . Два тетраедри, які поєднуються одним атомом кисню називаються димірами і відповідають формулі Si2O76-. Тетраедри також можуть бути поєднані двома атомами двома кисню і формують безкінечні ланцюги (триміри, чотириміри тощо). Хімічна формула таких ланцюгових чи розгалужених полімерів - SixO3x+12(x+1)-. В деяких силікатах (наприклад в кварці і польовому шпаті) тетраедри повністю поєднані в каркасну структуру, і всі атоми кисню є містковими (спільними). Всі ці структури (тетраедри, ланцюги, розгалужені ланцюги, плоскі сітки, неправильні тривимірні утворення) можуть бути присутніми в силікатному склі.
Міра з’єднання тетраедрів кремнезему, або ступінь полімеризації, впливає на хімічні і фізичні властивості силікатних розплавів.
За спроможністю формувати високо полімеризовані сполуки в розплавах катіони хімічних елементів можна умовно поділити на дві групи: сіткоутворювачі і сіткомодифікатори.
Сіткоутворювачами, в першу чергу, є відносно малі іони з великим зарядом (Si4+, а також Al3+, P3+, інколи Fe3+, Ti4+, B3+, тобто переважно ті катіони які можуть заміщувати кремній в тетраедричних позиціях з КЧ=4).
Інші поширені катіони природних силікатних розплавів, що мають більший радіус, і, як правило, менший заряд (Ca2+, Mg2+, Fe2+, K+, Na+, і H+) є сіткомодифікаторами. Ці іони не можуть замістити силікон в тетраедрах і їхні позитивні заряди можуть бути збалансовані лише за рахунок розділу місткових з’єднань кисню. Відповідно, збільшення вмісту сіткомодифікаторів призводить до розриву зв’язків між тетраедрами, тобто асиміляція силікатним розплавом речовини яка містить сіткомодифікатори призводить до прогресивної деполімеризації.
В якості емпіричного показника ступеню полімеризації використовують:
1) відношення (NBO/T) загальної кількості немісткових атомів кисню (NBO) до кількості іонів (Si4+ та Al3+) в тетраедричних позиціях (T) магми - це відношення є власне показником деполімеризації, його використання добре обгрунтовується з теоретичних позицій однак викликає зрозумілі утруднення на практиці. Відомі також рівняння регресії які пов’язують коефіцієнти розподілу мікроелементів (що займають октаедричні позиції) між твердою фазою і розплавом з величиною цього відношення:
| lnD=a*ln(NBO/T)+b/T |
2) відношення (R) загальної кількості атомів кисню до суми основних сіткоутворюючих атомів в магмі:
| R =O/(Si+Al+P) |
Величина останнього відношення в гранітних розплавах близька до 2 (в високо полімеризованому розплаві чистого кремнезему R SiO2=2), а в ультраосновних - приблизно рівна 3 (в розплаві чистого форстериту R MgSiO4=4).
Як і передбачалось, при зростанні величини індексу R в’язкість розплавів зменшується.
Для розрахунку в’язкості безводного силікатного розплаву петрогенні окисли слід поділяти на 2 типи:
ð ланцюгоутворювачі: SiO2, KAlO2, NaAlO2, Ca0, 5AlO2, Mg0, 5AlO2;
ð ланцюгомодифікатори: CaO, K2O, Na2O, MgO, FeO, TiO2, Al2O3.
14. Вплив структури мінеральних фаз та властивостей ізоморфних елементів (заряди та ефективні радіуси іонів) на значення їх коефіцієнтів розподілу мінерал/розплав.
Коефіцієт розподілу К для елементу М, що перерозподіляється між існуючим розплавом і кристалом визначається наступним чином: К=Мкр/Мрозп. вплив структури мінеральнх фаз та властивостей ізоморфних елементів для визначення коефіцієнту розподілу можна привести на прикладі розподілу елементів між авгітом та основним розплавом. за результатами багатох дослідників встановлено, щ о ті елементи, що мають більший онний радіус мають нижче значення К. Наявність на графіках двох піків при наявності двох різних значень пояснюється існуванням в авгіті двох координаційних позицій М1 і М2. Чітка крива зниження К при зростанні іонного радіусу може порушуватись для одних і тих же елементів через наявність кількох валентних форм чи стану окисленості елементів. Іонні радіуси елементів або стан окисленості перешкоджають їх входу до кристалічної фази. До таких елементів відносяться крупні: рубідій, цезій, барій високо зарядні цирконій і гафній.
15. Хімічна рівновага в природних системах та її умови. Константа рівноваги та її залежність від температури та інших факторів. Співідношення між константами рівноваги реакцій міжфазового обміну елементів та їх коефіцієнтами розподілу. Їх використання.
В загальному випадку, для будь-якої реакції типу
n× B + m× C < => k× R + l× S
DG визначається наступним чином:
DG = R× T× ln[(a’Rk× a’Sl)/(a’Bn× a’Cm)] – R× T× lnkP
де kP = (aRk× aSl)/(aBn× aCm) - константа рівноваги
R – універсальна газова постійна; T – абсолютна температура, a’R, a’S, a’B, a’C – нерівноважні активні концентрації відповідних речовин на початку реакції, а aR, aS, aB, aC – ті ж концентрації відповідних речовин після досягнення реакцією рівноваги.
Залежність kP від Т при постійній Р, визначається рівнянням Ван-Гофа: ln kP=-(∆ H/RT)+B
де, В – постійна інтегрована.
16. Типи дифузії в природних системах. Швидкість дифузії компонентів як головний кінетичний фактор та його вплив на коефіцієнти розподілу хімічних елементів.
В твердому тілі за локалізацією в просторі виділяються наступні типи дифузії (які, тією чи іншою мірою, контролюють процеси зміни порід та встановлення рівноваги між мінералами):
1) поверхнева дифузія (по поверхні);
2) міжзернова дифузія (по границям зерен);
3) об’ємна дифузія (через речовину мінеральних зерен).
Швидкість дифузії виражено законом Фіка. Згідно закону Фіка, або інакше - першого закону Fick's, стаціонарний потік, J, якоїсь речовини через площину є пропорційним до градієнту концентрацій цієї речовини в напрямку перпендикулярному до площини.
Інше формулювання першого закону Fick's таке: існування градієнту концентрацій в розплаві або твердому тілі (яке є однорідним в інших відношеннях) в загальному випадку породжує потік відповідного елементу чи хімічної речовини в напрямку протилежному до градієнту.
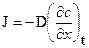
| |
| Jm= -Dm× (¶C/¶x)× S× dt |
Знак (-) вказує що потік спрямований в напрямку протилежному до зростання концентрації (в напрямку до області нижчих концентрацій). Коефіцієнт пропорційності, D, є коефіцієнтом дифузії. Розмірність потоку J - одиниця маси на площу в одиницю часу, наприклад, моль/см2*с. Розмірність коефіцієнту дифузії (найчастіше м2/с або см2/с) в загальному випадку залежить від розмірності концентрації (наприклад, якщо концентрація виражена в одиницях об’єму, як роблять в кінетиці, коефіцієнт дифузії матиме розмірність см-1с-1). Коефіцієнт дифузії повинен бути визначений експериментальним шляхом і залежатиме від природи дифундуючої речовини, властивостей системи де відбувається дифузія і, як завжди, від температури. В загальному випадку коефіцієнт дифузії не є незалежним від градієнту концентрацій.
Якщо бути точним, рівняння вище наведене рівняння є справедливим якщо дифузія відбувається лише в одному напрямку. Більш загальним виразом першого закону Fick's, який є чинним у тривимірному просторі є:
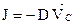
|
де
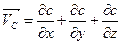
|
|
|