
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторна робота 6
|
|
АЛЬДЕГІДИ ТА КЕТОНИ
Контрольні питання
1. Напишіть рівняння реакції окиснення ізопропилового спирту розчином KMnO4.
2. Напишіть рівняння реакції срібного дзеркала для пропіонового альдегіду.
3. Поясніть зміну кольору розчину в пробірці при нагріванні суміші альдегіду та реактиву Фелінга.
4. Наведіть рівняння реакцій утворення оксимів та гідразонів.
5. Опишіть реакції конденсації для карбонільних сполук на прикладі пропіонового альдегіду.
6. Які альдегіди вступають в реакцію Канніццаро?
7. Які продукти одержуються при спільній конденсації пропіонового та триметилоцтового альдегідів?
8. Наведіть схему одержання карбамідо-формальдегідної смоли.
9. Які сполуки можна відкривати йодоформною пробою? Напишіть рівняння реакції, поясніть її механізм.
Альдегіди і кетони відносяться до карбонільних органічних сполук, у молекулах яких є група > С=О (карбоніл або оксогрупа).
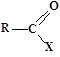 |
Загальна формула карбонільних сполук:
У залежності від типу замісника Х ці сполуки підрозділяють на альдегіди (Х = Н), кетони (Х = R, R') та карбонові кислоти (Х = ОН) і їхні похідні (Х = ОR, NH2, NHR, Hal і т.д.).
Властивості альдегідів і кетонів визначаються будовою карбонільної групи > C=O.
Атоми вуглецю і кисню в карбонільній групі знаходяться в стані sp2-гібридизації. Вуглець своїми sp2-гібридними орбіталями утворює 3 σ -зв'язки (один з них - зв'язок С-О), що розташовуються в одній площині під кутом близько 120° один до одного. Одна з трьох sp2-орбіталей кисню бере участь у σ -зв'язку С-О, дві інші мають неподілені електронні пари.
Електрони кратного зв'язку С=О, особливо більш рухливі π -електрони, зміщені до електронегативного атома кисню, що приводить до появи на ньому часткового негативного заряду. Карбонільний вуглець здобуває частковий позитивний заряд.
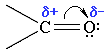
Тому вуглець піддається атаці нуклеофільними реагентами, а кисень - електрофільними, у тому числі Н+.
Для карбонільних сполук характерні реакції різних типів:
· приєднання за карбонільною групою;
· полімеризація;
· конденсація;
· відновлення й окиснення.
Більшість реакцій альдегідів і кетонів перебігає за механізмом нуклеофільного приєднання (AN) за зв'язком С=О. Реакційна здатність у таких реакціях зменшується від альдегідів до кетонів:
 |
формальдегід альдегіди кетони
Це пояснюється, головним чином, двома факторами:
1) вуглеводневі радикали в групі С=О збільшують просторові перешкоди приєднанню до карбонільного атома вуглецю нових атомів або атомних груп;
2) вуглеводневі радикали за рахунок + I -ефекта зменшують позитивний заряд на карбонільному атомі вуглецю, що утрудняє приєднання до нього нуклеофільного реагенту.
6.1. Одержання оцтового альдегіду
В пробірку поміщають 1 мл етилового спирту, 3 - 4 мл хромової суміші (К2Сr2O7 + H2SO4) та “кипілки”. Пробірку закривають пробкою з газовідвідною трубкою і обережно нагрівають. Кінець газовідвідної трубки опускають у пробірку з 2 мл води. Оцтовий альдегід, що утворився, розпізнають за характерним запахом і появою забарвлення при додаванні фуксинсірчистої кислоти. Записують спостереження та рівняння реакції.
6.2. Реакція срібного дзеркала
У пробірку, що промита розчином NаОН, поміщають 2 - 3 мл 1%-го розчину АgNО3, та додають краплями 5%-й розчин NH3 так, щоб осад, що утворюється спочатку, знову розчинився. До одержаного аміачного розчину оксиду срібла [Ag(NH3)2]OH приливають 1 мл розчину мурашиного альдегіду і суміш обережно нагрівають. На внутрішній поверхні пробірки з’являється характерний сріблистий наліт металічного срібла. Запишіть спостереження та рівняння реакції.
6.3. Реакція відновлення реактиву Фелінга
Приготування реактиву Фелінга. Готують два розчини.
Розчин I: сульфат міді у водному розчині 3, 5 г СuSО4· 5Н2О в 50 мл Н2О
Розчин II: виннокислий калій-натрій у водно-лужному розчині (17, 3 г сегнетової солі і 6 г їдкого натру в 50 мл Н2О).
Змішують рівні об’єми розчинів I і II. При цьому з’являється характерне синє забарвлення.
Проведення досліду з відновлення реактиву Фелінга.
В пробірку наливають 2 - 3 мл свіже приготовленого реактиву Фелінга і додають 0, 5 - 1 мл розчину формальдегіду. Реакційну суміш обережно нагрівають. Випадає червоний осад оксиду міді (I).
Напишіть рівняння відповідних реакцій.
6.4. Реакція альдегідів з фуксинсірчистою кислотою
В пробірку до 1 мл фуксинсірчистої кислоти додають декілька крапель формаліну.
Спостерігають поступове забарвлення розчину. Барвник фуксин, з’єднуючись з сірчистою кислотою, утворює безбарвну фуксин-сірчисту кислоту. При взаємодії з альдегідом фуксин, що видаляється, забарвлює розчин в малиновий колір.
6.5. Одержання ацетону піролізом ацетату кальцію
На 1/4 частину висоти пробірки насипають сухий ацетат кальцію і розподіляють його на нижній стінці пробірки. Після цього пробірку закривають пробкою з вигнутою під тупим кутом газовідвідною трубкою і закріплюють в штативі з нахилом в сторону пробки. Кінець газовідвідною трубки опускають у пробірку-приймач, що містить 1, 5 - 2 мл води. Прогрівають всю пробірку, потім прожарюють її, починаючи з дна. При піролізі ацетату кальцію утворюється ацетон, який розчиняється при відгонці у воді, що є в пробірці-приймачі. Через 5 - 7 хвил об’єм рідини в приймачі збільшується приблизно вдвічи. Напишіть рівняння реакції одержання ацетону з ацетату кальцію.
6.6. Йодоформна проба (проба Лібена)
Йодоформна проба дозволяє відкривати ацетон у водних розчинах при концентрації його біля 0, 04%. До розчину ацетону додають трошки розтертого в порошок йоду і краплями при струшуванні додають б - 10%-ний розчин гідроксиду натрію до обезбарвлення йоду. Без нагрівання випадає осад йодоформу. Напишіть рівняння реакції утворення йодоформу з ацетону. При піролізі ацетату кальцію, крім ацетону, одержується карбонат кальцію. Для виявлення його до суміші, що міститься у пробірці, після охолодження додають декілька мілілітрів 10%-ного розчину соляної кислоти. Відбувається виділення СО2. Напишіть рівняння реакції.
6.7. Одержання уротропіну і його гідроліз
В фарфорову чашку наливають 5 мл формаліну і при помішуванні скляною паличкою додають концентрований розчин аміаку до появи запаху аміаку. Випаровувати воду з реакційної суміші спочатку при нагріванні чашки на азбестовій сітці, потім на водяній бані. В процесі випаровування суміш помішують паличкою. Одержаний уротропін очищають перекристалізацією з етилового спирту.
6.8. Деполімеризація параформальдегіду
В пробірку вносять трохи параформальдегіду і додають 1 мл 10%-ного розчину сірчаної кислоти. Пробірку закривають пробкою із зігнутою газовідвідною трубкою, кінець якої занурено в другу пробірку, що містить 1 мл води і занурену в стакан з льодяною водою. При нагріванні параформальдегіду він деполімеризується, формальдегід, що утворюється, відганяється в пробірку з водою. У водному розчині виявляють формальдегід якісною реакцією з фуксинсірчистою кислотою (дослід 1.4). Для цього до водного розчину формальдегіду додають 1 мл безбарвного розчину фуксинсірчистої кислоти. На протязі декількох хвилин з’являється червоно-фіолетове забарвлення. Напишіть схеми реакцій полімеризації і деполімеризації формальдегіду (степінь полімеризації = 10).
6.9. Альдольна і кротонова конденсація оцтового альдегіду. Осмолення оцтового альдегіду
В пробірку наливають 3 мл 10%-ного розчину гідроксиду натрію, додають 5 - 6 крапель оцтового альдегіду і суміш нагрівають. Спочатку утворюється альдоль (він має приємний запах), потім ненасичений кротоновій альдегід, що має різкий запах. (Нюхати обережно!) При тривалому нагріванні рідина стає бурою, утворюється смола. Напишіть рівняння реакцій альдольної і кротонової конденсації оцтового альдегіду і розгляньте механізми цих реакцій (в лужному середовищі).
|
|