
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кислота — сложное вещество, при диссоциации которого образуется только один тип катионов — ионы водорода.
|
|
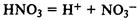
Классификация кислот.

Соляная кислота — водный раствор газа хлоро-водорода в воде.
Химические свойства. Кислоты изменяют цвет индикаторов: лакмус окрашивается в красный цвет, метилоранж — в желтый.
При реакции с основаниями образуется соль и вода (реакция нейтрализации). В реакцию вступают как растворимые, так и нерастворимые в воде основания:
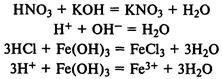
При реакции с основными оксидами образуются со ли:
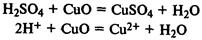
Кислоты реагируют с металлами, находящимися в ряду напряжений до водорода, при этом выделяется газообразный водород и образуется соль:
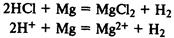
Сильные кислоты реагирует с солями слабых кислот, вытесняя слабые кислоты из их солей:
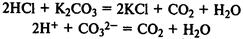
Получение кислот. Многие кислоты можно получить при реакции кислотных оксидов с водой:
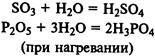

Концентрированная серная кислота при обычной температуре не действует на многие металлы. По этой причине, например, безводная серная кислота в отличие от её растворов может сохраняться в железной таре.
Но концентрированная серная кислота действует почти на все металлы при нагревании. При этом образуются соли серной кислоты, однако водород не выделяется, а получаются другие вещества, например сернистый газ.
Так, при нагревании концентрированной серной кислоты с медью вначале серная кислота окисляет медь до окиси меди, а сама восстанавливается при этом до сернистой кислоты, которая тотчас же разлагается на сернистый газ и воду:
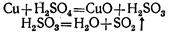
Образовавшаяся окись меди реагирует с избытком серной кислоты, образуя соль и воду:
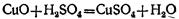
Таким образом, окись меди является промежуточным веществом в этой реакции. Сложив эти уравнения, мы получим итоговое уравнение реакции, в которое входят только исходные и конечные вещества:
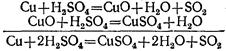
|
|