
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Общие принципы работы МГЭ.
|
|
Лекция 6. Электрохимическая коррозия (3 ч).
Наиболее распространенным и опасным видом коррозии является электрохимическая коррозия (ЭХК). Она всегда сопровождается образованием электрического тока, поэтому может протекать только в токопроводящих средах, содержащих электролиты. Такими средами являются: 1) водные растворы солей, кислот, щелочей; 2) морская и речная вода; 3) пластовые воды нефтяных месторождений; 4) буровые растворы; 5) атмосфера влажных газов; 6) влажная почва.
Возникновение тока при ЭХК связано с образованием на поверхности металла микрогальванических элементов (МГЭ), в которых корродирующий металл является анодом. Роль катода выполняют участки металлического материала, имеющие по сравнению с катодом более положительный или менее отрицательный электродный потенциал. Катодом могут быть:
1. Примеси других металлов или их соединения. Например, в стали и чугуне роль катода могут выполнять примеси Co, Ni, Cu, а также карбиды железа FenCm.
2. Продукты химической коррозии металла, например, оксидные пленки.
3. Деталь изделия, выполненная из другого, менее активного, металла.
Отметим, что если структура поверхности металла неоднородна, то МГЭ может образоваться и в отсутствие примесей или контакта с другим металлом.
МГЭ образуются на поверхности металла в большом количестве. Их называют накоротко замкнутыми и микрогальваническими по следующим причинам:
а) участки металла с разными значениями электродных потенциалов при замыкании цепи образуют гальванопару, в которой возникает Э.Д.С.;
б) размеры анода и катода, а также расстояния между ними очень малы;
в) анод и катод непосредственным образом контактируют друг с другом, поэтому в МГЭ, в отличие от искусственных ГЭ, для переноса электронов от анода к катоду внешняя цепь, т.е. проводник 1-го рода не требуется.
Общие принципы работы МГЭ.
Мы уже рассматривали, что в основе ЭХК, как и любого коррозионного процесса, лежит гетерогенная ОВР, которая проходит на поверхности металла. Реагентами в данной ОВР являются:
1. Сам металл, выполняющий роль восстановителя. При этом окислению, а следовательно, коррозионному разрушению всегда подвергается анод, т.е. наиболее электрохимически активный металл в составе металлического материала. Сущность процесса разрушения анода заключается в том, что его атомы необратимо окисляются до катионов, например: Zn0 – 2e ® Zn2+. Образующиеся катионы переходят в водную фазу.
2. Очень важно! Материал катода в процессе ЭХК никаким превращениям не подвергается. На его поверхности происходит восстановление наиболее активного окислителя из окружающей среды, который называется деполяризатором. Сущность катодного восстановления деполяризатора заключается в принятии им на поверхности катода электронов, перешедших с анода.
Роль деполяризатора могут выполнять:
1) в кислой среде (рН< 7) – ионы водорода H+, которые восстанавливаются по следующей реакции: 2H+ + 2е → Н2. Этот процесс называется водородной деполяризацией.
Иногда водородная поляризация может протекать и в щелочной среде с участием воды в качестве окислителя: 2H2O + 2е → Н2 + 2ОН-.
2) в нейтральной и щелочной средах (pH≥ 7) деполяризатором обычно является атмосферный кислород O2, который всегда присутствует в водной среде и восстанавливается по следующей реакции: О2 + 2H2O + 4е → 4ОН-. Этот процесс называется кислородной деполяризацией. Этот тип деполяризации является основным при контакте металла с речной, морской, пластовой водой, влажной почвой и воздушной атмосферой.
Иногда кислородная деполяризация может протекать и в кислой среде:
О2 + 4H+ + 4е → 2H2O.
Прогнозирование возможного типа деполяризации производят по следующему правилу. Если потенциал металла положительнее потенциала кислородного электрода, то его ЭХК невозможна. Пример – золото. Если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода, то ЭХК возможна с поглощением кислорода и невозможна с выделением водорода. Если потенциал металла отрицательнее потенциала водородного электрода, то возможна ЭХК как с поглощением кислорода, так и с выделением водорода. Примеры: щелочные и щелочноземельные металлы, Al, Zn, Mn, в некоторых случаях Fe. Таким образом, большинство металлов может подвергаться ЭХК с поглощением кислорода и лишь некоторые металлы – с выделением водорода.
Перенос электронов от анода к катоду происходит в металлическом материале напрямую, т.к. они накоротко замкнуты. Для замыкания цепи в окружающей среде должен присутствовать электролит, анионы которого обеспечивают проводимость водной фазы.
Роль анионов-проводников тока в водной среде могут выполнять:
1) в кислой среде – кислотные остатки кислот-деполяризаторов (SO42-, Cl- и т.п.), которые остаются в избытке после восстановления на катоде ионов водорода H+;
2) в нейтральной или щелочной среде это анионы ОН-, образующиеся при восстановлении О2 на катоде.
При взаимодействии образующихся на аноде катионов металла с анионами, остающимися в избытке или образующимися на катоде, образуются вторичные продукты коррозии:
1) в кислой среде образуются соли, например: Fe2+. + 2 Cl- ® FeCl2.
2) в нейтральной и щелочной средах образуются гидроксиды и оксиды, например Met+2 + 2OH- = Met(OH)2 → MetO + H2O. В случае железа при рН≥ 7 образуется бурая ржавчина (см. схему ниже).
Таким образом, для образования МГЭ и протекания в нем ЭХК обязательны следующие условия:
1. Наличие в металле или металлическом материале участков с различными значениями электродных потенциалов.
2. Наличие контактирующей с металлом токопроводящей среды, содержащей воду с растворенными в ней электролитами.
3. Присутствие деполяризатора в токопроводящей среде.
На скорость ЭХК влияют те же факторы, что и при коррозии любого вида – это состав, степень неоднородности и состояние поверхности металлического материала, наличие в нем механических напряжений; температура, давление; состав, уровень рН и скорость движения коррозионной среды; наличие защитных пленок на поверхности металла (см. лекцию 4); присутствие в почве и горных породах анаэробных бактерий, усиливающих коррозию.
В то же время для ЭХК характерно влияние и других факторов:
1. Природа металла и находящихся в нем примесей. Так, чем больше разность электродных потенциалов анода и катода, тем больше Э.Д.С. возникающего МГЭ, и тем больше скорость ЭХК.
2. Наличие в почве блуждающих токов, ускоряющих анодное окисление металлического оборудования и трубопроводов. Они появляются в подземных металлических сооружениях в связи с работой электрифицированного транспорта и электрических устройств, использующих землю в качестве токопровода. Источниками блуждающих токов являются линии электрифицированных железных дорог, линии электропередачи, установки катодной защиты и др. Блуждающие токи стекают, как правило, с небольшой площади поверхности, что приводит к очень быстрому образованию глубоких язв в металле.
3. Явление поляризации. При работе МГЭ уменьшается разность начальных электродных потенциалов, что сопровождается уменьшением коррозийного тока. Этот процесс называется поляризацией. Различают анодную и катодную поляризацию. При анодной поляризации в случае усиленного растворения металла катионы металла медленнее переходят в раствор, чем электроны отводятся в катодную область. Вследствие этого катионы металла накапливаются у поверхности анода, и его потенциал смещается в сторону положительных значений.
Катодная поляризация сопровождается смещением потенциала катода в сторону отрицательных значений вследствие низкой скорости восстановления деполяризатора.
Схемы процесса ЭХК в различных условиях:
1. ЭХК в условиях контакта двух металлов или при контакте металла и содержащейся в нем примеси.
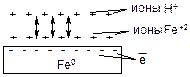 |
Пример: железная пластина в растворе кислоты подвергается химической коррозии по реакции: Fe0 + H2+1SO4(разб) = Fe+2SO4 + H20↑. В отсутствие катода окисление железа, едва начавшись, резко замедляется, т.к. катионы Fe+2 концентрируются на поверхности металла и препятствует доступу к ней окислителя, т.е. ионов H+:
Железо в промышленности используется в виде сталей и сплавов. Поэтому оно всегда содержит примеси с более положительным значением электродного потенциала, например, вкрапления меди или углерода, которые накоротко замкнуты с железным материалом. При контакте такого сплава или стали с раствором электролита (в данном примере это раствор H2SO4) возникает МГЭ, в котором железо является анодом, а медь или углерод – катодом. В результате начинает уже протекать не химическая, а ЭХК, скорость процесса резко возрастает.
 |
 |
В нейтральной или щелочной среде ЭХК протекает аналогичным образом с той разницей, что деполяризатором является растворенный в воде кислород, а продуктом вторичного процесса является не соль железа, а ржавчина:
Важно! Дальнейшее превращение гидроксида в ржавчину возможно только для железа. В случае остальных металлов конечным вторичным продуктом является гидроксид общей формулы Met(OH)n, где n = 2 или 3 в зависимости от характерной степени окисления металла.
2. ЭХК в условиях неодинаковой аэрации.
Влияние концентрации деполяризатора на скорость ЭХК проявляется в условиях неодинаковой аэрации. Напомню, что неодинаковая аэрация – это различная концентрация кислорода в объеме раствора электролита (см. лекцию 4).
Процесс протекает следующим образом. Поверхность железа под действием O2 подвергается химической коррозии по уравнению: Fe + O2 → FeO:
 |
Наибольшая концентрация кислорода наблюдается в поверхностном слое капли. Поэтому максимальная скорость образования оксида железа FeO и его наибольшее накопление на поверхности металла происходит по периметру капли. Под центром капли у поверхности железа концентрация кислорода низка, в этой области образование оксида железа незначительно. Оксид железа не только выполняет роль защитной пленки, но имеет более положительный потенциал, чем железо. В результате возникает МГЭ, в котором железо под центром капли является анодом, а FeO по краю капли – катодом. В результате проходящей ЭХК под центром капли возникают углубления и даже сквозные отверстия.
ЭХК в условиях неодинаковой аэрации широко распространена в нефтяной отрасли. Ее возникновению сильно способствует образование застойных зон сырой нефти в аппаратах и трубопроводах, а при образовании в застойных зонах осадков процесс еще больше ускоряется.
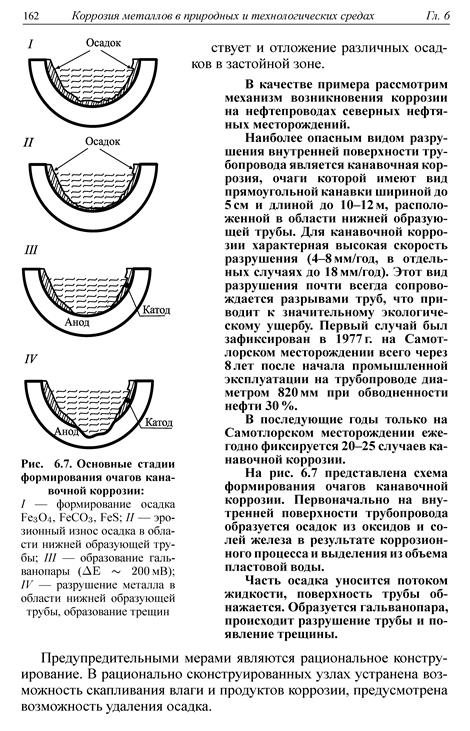
3. ЭХК в условиях повреждения защитного металлического покрытия.
Одним из способов защиты металлического материала от коррозии является нанесение на него покрытия из другого металла.
Металлические покрытия делятся на анодные и катодные. Для получения анодного покрытия на защищаемый металл наносят слой электрохимически более активного металла. Пример – оцинкованное железо. Если цинковое покрытие не повреждено, то железо корродировать не может, т.к. к нему нет доступа окислителя. В этом случае может происходить только ХК самого покрытия.
Однако при повреждении или разрушении покрытия в среде электролита возникает ЭХК вследствие того, что:
1) образуется МГЭ, в котором цинк является анодом, а железо – катодом;
2) электрическая цепь замыкается, т.к. оба электрода теперь имеют доступ к токопроводящей среде.
При повреждении анодного покрытия будет разрушаться анод, т.е. само покрытие, но не защищаемый металл. Поэтому анодные покрытия применяются в тех случаях, когда велика опасность их повреждения (например, оцинкованные корпуса автомобилей).
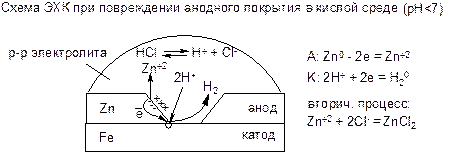 |
В нейтральной и щелочной средах ЭХК при повреждении анодного покрытия протекает аналогично. Отличие в том, что роль деполяризатора выполняет О2 (K: O2 + 2H2O + 4e → 4OH-), а в качестве продукта вторичного процесса образуется соответствующий гидроксид, например Zn(OH)2.
Катодные покрытия делают из металла электрохимически менее активного, чем защищаемый металл. Пример – луженое железо, в котором для катодного покрытия железа используют олово. При повреждении катодного покрытия в токопроводящей среде возникает МГЭ, в котором олово будет катодом, а железо – анодом, которое и будет подвергаться коррозии. Поэтому катодные покрытия применяются при небольшой вероятности их повреждения (например, для внутреннего покрытия консервных банок или для покрытия церковных куполов).
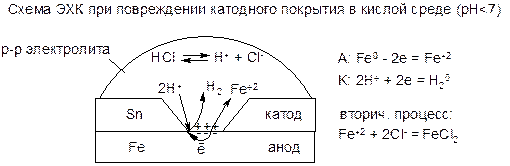 |
В нейтральной и щелочной средах ЭХК при повреждении катодного покрытия протекает аналогично с участием О2 в роли деполяризатора. Вторичным продуктом является гидроксид разрушаемого металла, а в случае железа – ржавчина.
Для количественной оценки процесса катодной деполяризации используются кислородный (КО) и водородный (КН) показатели. КО – это отношение объема О2, поглощенного в процессе ЭХК, к площади поврежденной поверхности S. КН – это отношение объема Н2, выделившегося в процессе коррозии, к величине S.
ЭХК представляет большую опасность для нефтегазового оборудования и трубопроводов. Она может происходить:
а) внутри труб и оборудования при хранении или транспортировке углеводородного сырья под действием примесей воды и влаги, содержащих электролиты (соли, органические кислоты, ПАВ и др.);
б) снаружи под воздействием почвенного электролита – влаги, пластовых и других подземных вод, содержащих соли, щелочи, органические и неорганические кислоты.
В некоторых случаях ЭХК, особенно в отсутствие достаточной защиты от нее, может вызвать очень быстрое появление сквозных свищей в металле трубы и этим вывести трубопровод из строя.
|
|