
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лекция 2. Строение, физико-химические и коррозионные свойства металлов и металлических материалов (2 ч).
|
|
Для понимания особенностей поведения металлов в коррозионных процессах необходимо вспомнить, что такое металлическая связь, каковы физико-химические свойства атомов и ионов металлов, а также какие реакции для них характерны. Напомню, что все это мы рассматривали в курсе химии, сейчас вспомним самые основные положения.
Металлы и их сплавы относятся к кристаллическим веществам. Они обладают трехмерной периодически повторяющейся атомной структурой в виде металлической кристаллической решетки. В ее узлах находятся атомы и катионы металла. которые постоянно обмениваются друг с другом электронами: М0 – ne ↔ M+n. В кристаллах металлов происходит трехмерная делокализация электронов, т.е. они свободно движутся в межатомном пространстве, образуя т.н. «электронный газ». За счет их притяжения к атомам и ионам металла осуществляется металлический тип связи:
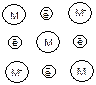 |
В металлической связи свободные электроны способны свободно перемещаться по кристаллу и переносить энергию из одной его части в другую. Это.обеспечивает высокую электро- и теплопроводность металлов. Металлическая связь ненасышена и ненаправлена. Вследствие этого многие металлы могут менять свою форму без потери прочности, т.е. имеют свойства ковкости и тягучести, а также способны, в отличие от неметаллов, образовывать сплавы.
Рассмотрим физико-химические характеристики металлов в свете Периодического закона Менделеева.
Металлические свойства элементов количественно характеризуются энергией ионизации (Еион). Это энергия, которую нужно сообщить атому для его превращения в положительно заряженный ион путем отрыва от него одного или нескольких электронов, например Zn0 – 2e ® Zn2+. Металлические свойства преобладают над неметаллическими у элементов, атомы которых содержат от 1 до 3 электронов на внешнем уровне (кроме В), у некоторых элементов, имеющих 4 электрона на внешнем уровне (Sn, Pb)., а также у всех d-элементов. Поэтому металлами являются все s-элементы (кроме H и He) и все d-элементы.. Среди р-элементов встречаются и металлы, и неметаллы.
Металлические свойства атомов тем больше, чем меньше Еион, т.е. чем легче оторвать от атома электрон. Поэтому чем выше металличность атома, тем ниже его относительная электроотрицательность, т.е. способность частицы притягивать электроны. У всех металлов О.Э.О. ниже, чем у всех неметаллов, поэтому в реакциях с неметаллами атомы металлов могут только отдавать им электроны, т.е. могут проявлять только восстановительные свойства. Атомы металлов окислителями быть не могут, поэтому наименьшая степень окисления металлов равна нулю. Катионы металлов образуются в результате отдачи электронов атомами и способны обратно присоединять эти отданные электроны. Поэтому катионы металлов могут проявлять окислительные свойства, а если они находятся в промежуточной степени окисления – то и восстановительные свойства.
Таким образом, атомы металлов способны участвовать в разнообразных ОВР, причем только в роли восстановителей. Вспомним и запишем основные типы окислителей, которые могут взаимодействовать с металлами:
1. Неметаллы.
2. Вода.
3. Соли в виде водных растворов.
4. Кислоты.
5. Водные растворы щелочей.
Все эти окислители могут разрушать металлы как в условиях природной коррозии, так и в различных технологических средах. С происходящими под их действием химическими реакциями мы познакомимся при рассмотрении отдельных видов коррозии. Впрочем, со многими из этих реакций вы уже знакомы из курса химии.
Рассмотренные свойства металлов объясняют, почему коррозия является самопроизвольным процессом. Большинство металлов, кроме Ag, Pt, Cu и, Au в природе находится в ионном состоянии – в виде оксидов, сульфидов, карбонатов и других соединений, входящих в состав металлических руд. Ионное состояние термодинамически более выгодно, чем атомное, т.к. имеет меньшую внутреннюю энергию. Вследствие этого при контакте оборудования, машин, материалов с коррозионно-активной средой атомы металлов в их составе стремятся перейти в более выгодное состояние с меньшим запасом энергии.
|
|