
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Загальна характеристика оксокислот
|
|
Сполуки, до складу молекул яких поряд із карбоксильною групою 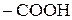 входить карбонільна
входить карбонільна 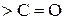 , називаються оксокислотами або альдегідокислотами і кетокислотами. Це гетерофункціональні сполуки, вони містять дві функціональні групи (
, називаються оксокислотами або альдегідокислотами і кетокислотами. Це гетерофункціональні сполуки, вони містять дві функціональні групи (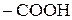 і
і 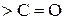 ).
).
Для назв оксокислот часто використовують тривіальні назви: піровиноградна, ацетооцтова та інші.
Номенклатура оксокислот
| Формула | Номенклатура | ||
| Систематична IUPAC | Раціональна | Тривіальна | |
| Альдегідокислоти | |||
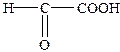
| 2-Оксоетанова | Формілмурашина | Гліоксилова |
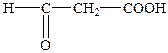
| 3-Оксопропанова | Формілоцтова | Малональдегідна |
| Кетокислоти | |||
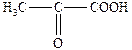
| 2-Оксопропанова | a -Кетопропіонова | Піровиноградна |
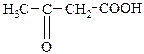
| 3-Оксобутанова | b -Кетобутиратна | Ацетооцтова |

| 4-Оксопентанова | g -Кетовалер’янова | Левулінова |
За номенклатурою ІUPAС головний ланцюг, який містить обидві функціональні групи, нумерується, починаючи з карбоксильної групи. Положення альдегідної або кетонної групи позначається відповідною цифрою з додаванням префікса «оксо-».
Наприклад:
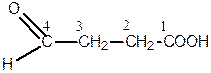
| 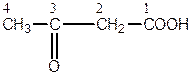
|
| 4-оксобутанова кислота | 3-оксобутанова кислота |
Раціональні назви будують від назв відповідних кислот із позначенням положення оксогрупи; атом Карбону, який безпосередньо зв’язаний із карбоксилом, позначається літерою a -, наступний b -, далі g - і т. і.
3. Природні джерела та способи добування оксокислот
Найпоширеніші способи добування: окиснення оксикислот; окиснення гліколів; гідроліз гемінальних дигалогензаміщених кислот; гідроліз оксонітрилів.
Наприклад, під час окиснення молочної килоти утворюється піровиноградна:
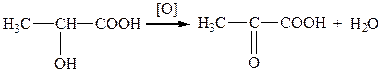
Гліоксилова кислота утворюється в результаті окиснення етиленгліколю:
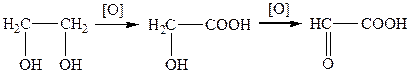
4. Хімічні властивості
Оксокислоти виявляють хімічні властивості, що обумовлені наявністю двох функціональних груп. І кислотні властивості, і властивості альдегідів або кетонів в оксокислотах більш виражені за рахунок взаємного впливу двох функціональних груп:
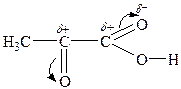
Найактивніші — a -оксокислоти. Їм характерні усі реакції карбоксильної групи: утворення солей, галогенангідридів, естерів, амідів та ін. Реакції за оксогрупою: реакція “срібного дзеркала”, утворення оксимів, фенілгідразонів, оксинітрилів, бісульфітних похідних тощо.
Типовими реакціями a -кетокислот є їх декарбоксилування під дією розведеної сульфатної кислоти за умов слабкого нагрівання та декарбонілування за умов нагрівання з концентрованою сульфатною кислотою:
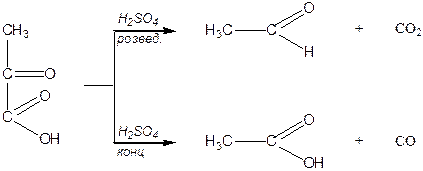
|
5. Окремі представники оксокислот та їх використання
Гліоксилова кислота поширена у природі, особливо у великій кількості вона міститься у недозрілих фруктах, а також у соку цукрового буряка. Гліоксилова кислота відіграє важливу роль у обмінних процесах у рослин і мікроорганізмів.
Піровиноградна кислоа широко розповсюджена у природі, є проміжним продуктом процесів молочнокислого і спиртового бродіння, окиснення вуглеводів в організмі. Вона утворюється за умов нагрівання (піролізу) виноградної кислоти, звідси її тривіальна назва — піровиноградна кислота:
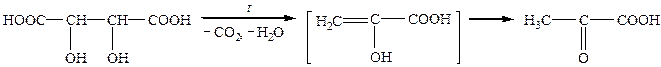
|
Ацетооцтова кислота утворюється за рахунок β -окиснення жирних кислот при метаболізмі. Кислота дуже нестійка і легко декарбоксилується з утворенням ацетону. Солі, естери та інші похідні ацетооцтової кислоти досить стійкі.
Ацетооцтовий естер відіграє важливу роль у теоретичній органічній хімії й органічному синтезі. Для ацетооцтового естеру характерне явище таутомерії - рухомої динамічної ізомерії. Одна з ізомерних форм естеру мітить кетогрупу (кетоформа), друга – гідроксильну групу (енольна форма).
Кето-енольна таутомерія ацетооцтового естеру:
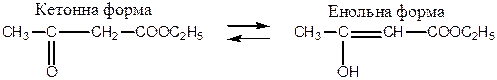
|
У хімічному відношенні ацетооцтовий естер реакційно здатний як за кетонною, так і за енольною формами. Реакції кетонної форми: відновлення воднем, приєднання 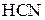 ,
, 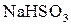 , взаємодія з гідроксиламіном, фенілгідразином. Реакції енольної форми: взаємодія з розчином ферум(ІІІ) хлориду (якісна реакція), реакція приєднання
, взаємодія з гідроксиламіном, фенілгідразином. Реакції енольної форми: взаємодія з розчином ферум(ІІІ) хлориду (якісна реакція), реакція приєднання 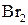 за місцем подвійного зв’язку, утворення натрій ацетооцтового естеру.
за місцем подвійного зв’язку, утворення натрій ацетооцтового естеру.
ГІДРОКСИКИСЛОТИ
Лекція №15 (2 години)
План
1. Класифікація, ізомерія, номенклатура гідроксикислот.
2. Способи добування гідроксикислот.
3. Фізичні властивості гідроксикислот.
4. Хімічні властивості гідроксикислот.
5. Окремі представники.
Ключові слова: гідроксикислота, оптична ізомерія, поляризація світла, кут питомого обертання, оптична активність, асиметричний (хіральний) атом Карбону, проекційні формули Фішера, рацемічна суміш, оптичні антиподи(енантіомери), молочна кислота, ціангідринний синтез, лактид, лактон.
Література: [2] с. 13 - 33; [3] с. 420 – 432
1. Класифікація, ізомерія, номенклатура гідроксикислот
Гідроксикислоти — органічні сполуки, молекули яких містять дві функціональні групи: карбоксильну та гідроксильну. Залежно від кількості карбоксильних груп розрізняють одно-, двох- та багатоосновні кислоти, а від кількості гідроксогруп (включаючи гідроксогрупу, яка входить до складу карбоксильної групи) — двох-, трьох- та багатоатомні оксикислоти.
За будовою вуглеводневого радикалу, з яким зв’язані окси- і карбоксильні групи, оксикислоти поділяють на аліфатичні (насичені і ненасичені), ароматичні, гетероциклічні.
Для назв оксикислот широко використовують тривіальні назви, а також но-менклатуру ІUPAC та раціональну.
Номенклатура гідроксикислот:
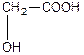
| Оксиоцтова, 2-гідроксиетанва або гліколева кислота (одноосновна, двоатомна) | |
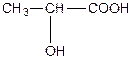
| a -оксипропіонова, 2-гідроксипропанова кислота або молочна (одноосновна, двоатомна). | |
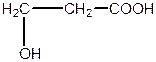
| b -оксипропіонова, 3-гідроксипропанова кислота (одноосновна, двоатомна) | |
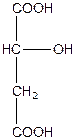
| Монооксиянтарна, 2-гідроксибутандіова або яблучна кислота (двоосновна, триатомна) | |
Ізомерія оксикислот залежить від будови карбонового скелету та положення функціональних груп.
Крім структурної ізомерії для оксикислоти характерна оптична ізомерія.
|
|