
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Поняття про первинний, вторинний, третинний та четвертинний атоми Карбону.
|
|
План
1. Предмет органічної хімії.
2. Розвиток теоретичних уявлень в органічній хімії.
3. Хімічний зв’язок в органічних сполуках.
4. Класифікація органічних сполук та реакцій за напрямком та механізмом.
5. Номенклатура органічних сполук.
Ключові слова: ятеорія віталізму, теорія радикалів, теорія типів, теорія хімічної будови органічних сполук, хімічний зв'язок, ковалентний зв’язок, гібридизація, атомна орбіталь, гібридизована орбіталь, s- та p- зв’язки, номенклатура.
Література: [1] с.4 - 20; [3] с. 5 - 19
1. Предмет органічної хімії
На початку XIX ст. поняття «органічна хімія» використовувалося стосовно хімії сполук, із яких складаються рослинні та тваринні організми. Виникнення теорії віталізму (від латинського vitalis – життєвий).
Органічна хімія – хімія вуглеводнів та їх похідних, до складу яких можуть входити майже всі елементи періодичної системи.
Значення органічної хімії. Вивчення основних теоретичних положень органічної хімії сприяє формуванню, розширенню і поглибленню фундаментальних, загальнопрофесійних, спеціальних знань, а також активному формуванню предметних і професійних компетенцій, спрямованих на виконання виробничих функцій.
2. Розвиток теоретичних уявлень в органічній хімії
Теорія радикалів (20‑ 30 рр. XIX ст. — Гей-Люсак, Велер, Лібіх).
Теорія типів (40‑ 50 рр. XIX ст. — Жерар, Дюма, Кекуле).
Теорія хімічної будови органічних сполук О.М. Бутлерова (1861 р.) та її значення. Суть теорії будови можна сформувати у вигляді наступних положень:
1. Атоми в молекулах розташовані не безладно. У молекулах існує певний порядок зв’язку атомів, який називають хімічною будовою (або просто “будовою”).
2. Властивості речовин залежать не лише від того, які атоми та в якій кількості входять до складу молекул, а й від того, в якому порядку вони сполучені між собою, тобто від хімічної будови молекул.
3. Атоми або групи атомів у молекулах взаємно впливають один на одного безпосередньо або через інші атоми. Найбільше впливають безпосередньо зв’язані атоми. Взаємний вплив атомів, безпосередньо не зв’язаних, значно слабший.
4. Відмінність у будові за однакового складу та молекулярної маси зумовлює явище ізомерії.
5. Хімічну будову можна встановити, вивчаючи властивості та перетворення речовин, і виразити її певною формулою.
Теорія О.М.Бутлерова не тільки пояснювала будову молекул усіх відомих органічних сполук та їх властивості, а й дала можливість теоретично передбачувати існування невідомих і нових сполук, знаходити шляхи їх синтезу. Подальшим розвитком теорії будови стало вчення про просторову будову молекул органічних сполук.
Розвиток теорії хімічної будови, стереохімічна гіпотеза Вант-Гофа та Ле-Беля. Гіпотеза О.М. Бутлерова (1862 р.) про тетраедричну будову атому Карбону.
3. Хімічний зв'язок в органічних сполуках
Типи хімічних зв'язків на (іонні, ковалентні, водневі, металічні й вандерваальсівські).
В молекулах органічних сполук атомами сполучаються, як правило, ковалентний зв’язок. Ковалентний зв’язок характеризується енергією, довжиною, полярністю і поляризованістю зв’язку та просторовою направленістю.
Квантово-механічні уявлення про природу ковалентного зв’язку. Електронна будова атому Карбону. Поняття про гібридизацію. Електронна будова простих, подвійних та потрійних карбон-карбонових зв’язків, s- та p- зв’язки.
Для атома Карбону розрізняють три валентні стани, які визначаються типом гібридизації.
Перший валентний стан – 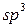 -гібридизація. У цьому випадку утворюються чотири гібридних орбіталі за рахунок гібридизації
-гібридизація. У цьому випадку утворюються чотири гібридних орбіталі за рахунок гібридизації 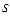 -орбіталі із трьома
-орбіталі із трьома 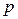 -орбіталями, які між собою утворюють кут 109°28¢ і орієнтовані до вершин тетраедра. Ці орбіталі приймають участь в утворенін s- зв’язків.
-орбіталями, які між собою утворюють кут 109°28¢ і орієнтовані до вершин тетраедра. Ці орбіталі приймають участь в утворенін s- зв’язків.
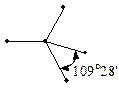
|
Другий валентний стан атому Карбону – 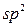 -гібридизація, за умов якої відбувається гібридизація однієї
-гібридизація, за умов якої відбувається гібридизація однієї 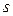 - і двох
- і двох 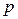 -орбіталей. Утворюються три однакові гібридизовані орбіталі, які розміщені в одній площині під кутом 120°. Негібридизована
-орбіталей. Утворюються три однакові гібридизовані орбіталі, які розміщені в одній площині під кутом 120°. Негібридизована 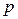 -орбіталь розташована перпендикулярно до цієї площини. Така гібридизація характерна для сполук із подвійним зв’язком, наприклад етену
-орбіталь розташована перпендикулярно до цієї площини. Така гібридизація характерна для сполук із подвійним зв’язком, наприклад етену 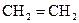 . Подвійний зв'язок є сполученням, s- та p- зв’язків.
. Подвійний зв'язок є сполученням, s- та p- зв’язків.
Третій валентний стан атому Карбону – 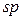 -гібридизація. Цей тип гібридизації здійснюється внаслідок гібридизації однієї
-гібридизація. Цей тип гібридизації здійснюється внаслідок гібридизації однієї 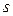 - і однієї
- і однієї 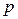 -орбіталі. Гібридизовані орбіталі розміщені лінійно під кутом 180°. Дві негібридизовані
-орбіталі. Гібридизовані орбіталі розміщені лінійно під кутом 180°. Дві негібридизовані 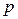 -орбіталі розташовані у взаємно перпендикулярних площинах і, перекриваючись бічними поверхнями, утворюють два p-зв’язки. Потрійний зв’язок являє собою сполучення одного s- і двох p-зв’язків. Така гібридизація характерна для сполук із потрійним зв’язком, наприклад етину
-орбіталі розташовані у взаємно перпендикулярних площинах і, перекриваючись бічними поверхнями, утворюють два p-зв’язки. Потрійний зв’язок являє собою сполучення одного s- і двох p-зв’язків. Така гібридизація характерна для сполук із потрійним зв’язком, наприклад етину 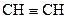 .
.
4. Класифікація органічних сполук та реакцій за механізмом та напрямком
В основу класифікації положено уявлення про будову карбонового ланцюгу молекули.

Для кожного із наведених класів органічних сполук прийнято окрему класифікацію залежно від наявності тих або інших функціональних груп, які визначають їх хімічні властивості.
Класифікація реакцій органічних сполук за механізмом: радикальні (R) та іонні (N, E); за напрямком та результатом реакції: заміщення — S (substitution);
приєднання — A (addition); відщеплення, елімінування — E (elimination).
Поняття про первинний, вторинний, третинний та четвертинний атоми Карбону.
Атом Карбону, що сполучений тільки з одним іншим атомом Карбону, називається первинним. Поняття вторинного, третинного та четвертинного атомів Карбону аналогічні.
6.Номенклатура органічних сполук.
Хімічна номенклатура – це сукупність правил назвоутворення окремих сполук та їх класів. Відомі три основні різновиди номенклатур для органічних сполук: тривіальна, раціональна, систематична або міжнародна (IUPAC).
Систематична (міжнародна) номенклатура утворює найбільш правильні, точні й індивідуальні назви органічних сполук. Основні принципи систематичної номенклатури були прийняті у 1892 р. на з’їзді хіміків у Женеві (Женевська номенклатура). На наступних з’їздах хіміків (Льєж, 1930 р., 1957 р.) до цієї номенклатури вносилися доповнення. Нині найповнішими є правила комісії із номенклатури органічних сполук при Міжнародній Спілці Чистої (теоретичної) і Прикладної (практичної) Хімії — скорочено називаються за першими літерами англійської назви цієї спілки  — правилами IUPAC. “Правила IUPAC” були прийняті на конференції IUPAC у 1957 р. у Парижі і в 1965 р. Цю номенклатуру постійно вдосконалюють. В її основу положено назви насичених вуглеводнів. Клас сполук позначається функціональним закінченням.
— правилами IUPAC. “Правила IUPAC” були прийняті на конференції IUPAC у 1957 р. у Парижі і в 1965 р. Цю номенклатуру постійно вдосконалюють. В її основу положено назви насичених вуглеводнів. Клас сполук позначається функціональним закінченням.
НАСИЧЕНІ ВУГЛЕВОДНІ
Лекція № 2 (2 години)
План
1. Загальна характеристика гомологічного ряду алканів.
2. Будова, ізомерія, номенклатура.
3. Поширення у природі та способи добування.
4. Фізичні та хімічні властивості алканів.
5. Окремі представники, похідні, їх значення і використання.
Ключові слова: карбоновий ланцюг, радикальний механізм реакцій, іонний механізм, номенклатура, ізомерія, структурні формули, алкани, гомологічний ряд, радикали, синтез Вюрца, інертність, реакція заміщення, крекінг, піроліз.
Література: [1] с. 21 - 33; [3] с. 133 – 145
1. Загальна характеристика гомологічного ряду алканів
Алкани - насичені вуглеводні, в молекулах яких атоми Карбону сполучені між собою s — зв’язками.
Алкани утворюють гомологічний ряд сполук, який відповідає загальній формулі 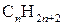 . Першим членом цього ряду є метан
. Першим членом цього ряду є метан 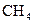 . Кожен наступний член ряду відрізняється від попереднього на групу
. Кожен наступний член ряду відрізняється від попереднього на групу 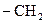 , яка називається гомологічною різницею.
, яка називається гомологічною різницею.
2. Будова, ізомерія та номенклатура алканів
Будова (стан 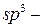 гібридизації, тип зв’язків, їх напрямленність). Структурні формули. Ізомерія алканів: структурна ізомерія, а саме ізомерія карбонового ланцюга, що обумовлена різноманітним порядком зв’язку атомів в молекулі.
гібридизації, тип зв’язків, їх напрямленність). Структурні формули. Ізомерія алканів: структурна ізомерія, а саме ізомерія карбонового ланцюга, що обумовлена різноманітним порядком зв’язку атомів в молекулі.
Номенклатура. Уявлення про радикали — структура та назва радикалів для перших чотирьох членів гомологічного ряду.
3. Поширення у природі та способи добування алканів
Алкани широко розповсюджені в природі. Здебільшого вони знаходяться у певних видах нафти, у природних та супутніх газах. Тверді насичені вуглеводні є головною складовою частиною бітумів, асфальтів, озокериту (гірський віск).
Основними способами промислового добування алканів із природних джерел є виділення їх у вигляді сумішей (фракцій) або індивідуальних сполук за допомогою, як правило, розгонки або ректифікації.
Найважливішим синтетичним методом одержання алканів є синтез Вюрца (1855р.) — взаємодія галогеналкілів з металічним натрієм:
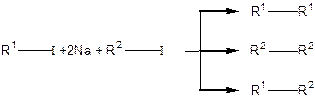
|
Алкани також можна добути із солей карбонових кислот, гідруванням ненасичених вуглеводнів, відновленням галогенопохідних.
4. Фізичні та хімічні властивості алканів
Закономірності зміни фізичних властивостей в гомологічному ряду і залежно від структури ізомерів.
Інертність у хімічному відношенні — за звичайних температур не окиснюються, не взаємодіють із концентрованою сульфатною кислотою та деякими іншими реагентами. Якісна реакція — алкани не знебарвлюють бромну воду та розчин калій перманганату. За певними умовами алкани вступають у реакції заміщення, окиснюються, за високих температур без доступу повітря відбувається крекінг і піроліз.
Реакції заміщення
Відбуваються за радикальним механізмом 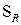 .
.
1. Галогенування
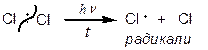
|
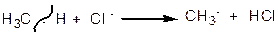
|
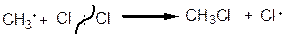
|
За таким же механізмом відбуваються реакції нітрування, сульфування та сульфохлорування.
2. Нітрування — реакція Коновалова, 1889 р.:
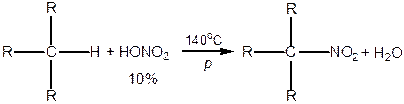
|
3. Сульфування — при взаємодії з димлячою сульфатною кислотою:

|
4. Сульфохлорування — дія на алкани сумішшю сірчистого газу та хлору:
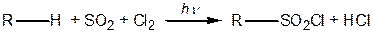
|
Сульфохлориди можна розглядати як хлорангідриди сульфокислоти, тому вони легко гідролізуються до сульфокислот 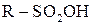 (
(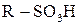 ).
).

|
Натрієві солі цих кислот називаються сульфонатами. Практичне значення мають сульфонати з числом атомів Карбону 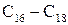 вони входять до складу синтетичних миючих засобів.
вони входять до складу синтетичних миючих засобів.
Окиснення алканів
За звичайних умов алкани стійкі до дії окисників, а в умовах нагрівання окиснюються з розривом карбонового ланцюга і утворенням різноманітних кисневмісних продуктів. Розроблено метод окиснення вищих насичених вуглеводнів під дією кисню повітря з метою добування вищих жирних кислот для миловаріння. Реакція відбувається з розривом карбонового ланцюга (реакція Намьоткіна):
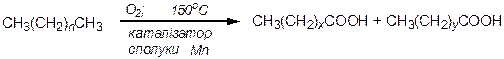
|
Повне окиснення — горіння. Підпалені на повітрі, вуглеводні горять, перетворюючись на 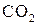 і
і 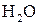 із виділенням великої кількості тепла. Реакція широко застосовується в енергетичних, а не в хімічних цілях. Таке згоряння палива відбувається у двигунах всіх типів.
із виділенням великої кількості тепла. Реакція широко застосовується в енергетичних, а не в хімічних цілях. Таке згоряння палива відбувається у двигунах всіх типів.
Крекінг, піроліз
Нагрівання вуглеводнів до високих температур (300°С ‑ 700°С, 1000°С) без доступу повітря призводить до їх розкладу, що супроводжується розривом карбонових ланцюгів і утворенням значно простіших насичених та ненасичених вуглеводнів. У цьому випадку відбувається гомолітичний розрив зв’язків С-Н і С-С. Може відбуватись також дегідрування, ізомеризація, циклізація та ароматизація вуглеводнів.
Крекінг має велике практичне значення. Реакція крекінгу важких фракцій нафти широко використовується для одержання алканів збагачених більш легкими фракціями - бензинів та газоподібних продуктів.
5. Окремі представники, їх значення та використання
Метан, етан, бутан. Використання насичених вуглеводнів в органічному синтезі.
Широке використання знаходять суміші насичених вуглеводнів. Вазелінове масло (у молекулах вуглеводнів міститься до 15 атомів Карбону) — прозора рідина без запаху і смаку, яку використовують у медицині, парфюмерії, косметиці. Вазелін (суміш рідких і твердих насичених вуглеводнів із кількістю Карбону до 25) застосовують як основу для виготовлення лікувальних мазей.
Парафін (суміш твердих вуглеводнів 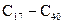 ) — біла тверда маса без запаху і смаку (
) — біла тверда маса без запаху і смаку ( ). Його застосовують для теплових процедур при лікуванні нефритів, артритів та інших хвороб. Із парафіну виготовляють свічки, ним просочують папір, який використовують для пакування продуктів тощо.
). Його застосовують для теплових процедур при лікуванні нефритів, артритів та інших хвороб. Із парафіну виготовляють свічки, ним просочують папір, який використовують для пакування продуктів тощо.
Озокерит, або гірський віск — суміш твердих вуглеводнів. Використовується для лікувальних теплових процедур.
АЛКЕНИ. АЛКАДІЄНИ
Лекція № 3 (2 години)
План
1. Загальна характеристика гомологічного ряду алкенів.
2. Будова, ізомерія, номенклатура.
3. Поширення у природі та способи добування алкенів.
4. Фізичні та хімічні властивості алкенів.
5. Окремі представники, похідні, їх значення і використання.
6. Загальна характеристика та будова алкадієнів.
7. Хімічні властивості алкадієнів, їх значення та використання.
Ключові слова: ненасичені вуглеводні, алкени, подвійний зв'язок, просторова ізомерія, реакція відщеплення, реакція приєднання, електрофільне приєднання, правилоВ.В. Марковникова, реакція Вагнера, озонування, полімеризація.
Література: [1] с. 34 - 53; [3] с.145 – 167
1. Загальна характеристика гомологічного ряду алкенів
Алкени - ненасичені вуглеводні, в молекулах яких атоми Карбону сполучені подвійним зв’язком. Алкени утворюють гомологічний ряд, сполуки якого мають загальну формулу СnН2n. Найпростішим представником акенів є етен С2Н4.
2. Будова, ізомерія, номенклатура алкенів
Будова (стан 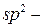 гібридизації). Подвійний ковалентний зв’язок - сполучення σ - та π - зв’язків. Ізомерія алкенів обумовлена будовою карбонового ланцюга та положенням подвійного зв’язку. Просторова — цис-транс -ізомерія. Номенклатура. Ненасичені радикали.
гібридизації). Подвійний ковалентний зв’язок - сполучення σ - та π - зв’язків. Ізомерія алкенів обумовлена будовою карбонового ланцюга та положенням подвійного зв’язку. Просторова — цис-транс -ізомерія. Номенклатура. Ненасичені радикали.
3. Поширення у природі та способи добування алкенів
Основний промисловий спосіб добування – крекінг та піроліз алканів.
Методи синтезу, як правило, основані на реакції відщеплення (елімінування) атомів або груп від сусідніх атомів Карбону:
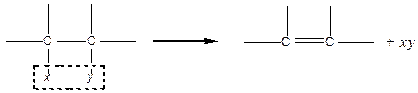
|
Способи одержання алкенів: дегідратація спиртів; дегідрогалогенування галогенопохідних алканів; дегалогенування віцинальних дигалогенопохідних алканів та ін. Правило Зайцева.
4. Фізичні та хімічні властивості алкенів
Закономірності зміни фізичних властивостей в гомологічному ряду і залежно від структури ізомерів.
Хімічні властивості алкенів обумовлені наявністю в їх молекулах подвійного зв’язку.
Реакції приєднання
Оскільки подвійний зв'язок виявляє електронодонорні властивості, алкени переважно вступають у реакції електрофільного приєднання за двостадійним механізмом.
Механізм реакції електрофільного приєднання 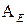 :
:
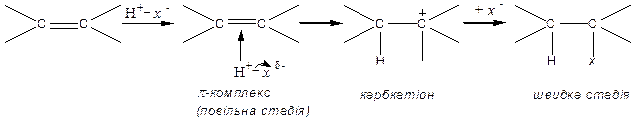
|
За таким механізмом приєднується: водень, галогени, галогеноводні, вода, кислоти тощо. Знебарвлення бромної води – якісна реакція на кратний зв’язок.
Правило В.В. Марковникова. Взаємний вплив атомів у молекулах. Індукційний ефект.
Реакції окиснення
Алкени легко окиснюються за звичайних умов під дією кисню повітря та окисників. Наприклад, алкени знебарвлюють водний розчин 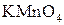 (реакція Вагнера) — це якісна реакція на алкени:
(реакція Вагнера) — це якісна реакція на алкени:
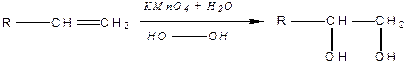
|
Сильні окисники окиснюють алкени до кислот та кетонів, що супроводжується розривом карбонового ланцюга за місцем подвійного зв'язку. Реакція їх горіння перебігає з утворенням кінцевих продуктів — води та вуглекислого газу (карбон (IV) оксиду).
Реакція озонування
Як специфічний окисник використовують озон. За продуктами гідролізу озонідів встановлюється місце розташування подвійного зв’язку у вихідному алкені.
Полімеризація алкенів
Важлива реакція, яка перебігає з утворенням цінних полімерних матеріалів. Відбувається за рахунок розриву подвійних зв’язків:
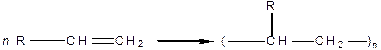
| |
| Мономер | Полімер (п — від 10 до кількох тисяч) |
Лінійна та ступінчаста полімеризація. Радикальна та іонна полімеризація.
5. Окремі представники, їх значення та використання
Етилен, пропілен, бутилен, їх промислові джерела та шляхи їх хімічної переробки. Поліетилен, поліпропілен, їх значення.
6. Загальна характеристика та будова алкадієнів
Вуглеводні, що містять у карбоновому ланцюгу два подвійних зв’язки, називають дієновими. Загальна формула сполук гомологічного ряду дієнових вуглеводнів - 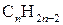 .
.
Дієни з кумульованими, супряженими та ізольованими подвійними зв’язками. Ізомерія алкадієнів обумовлена будовою карбонового ланцюгу та положенням подвійних зв’язків. Номенклатура.
7. Хімічні властивості алкадієнів, їх значення та використання
Хімічні властивості алкадієнів обумовлені наявністю подвійних зв'язків.
Дієни з кумульованими та ізольованими подвійними зв’язками мають властивості близькі до властивостей олефінів. Важливою особливістю сполук із спряженими зв’язками є їх значно вища реакційна здатність, порівняно зі сполуками, що мають ізольовані зв’язки. Крім того, вони здатні вступати в реакції приєднання таким чином, що приєднання відбувається до першого та четвертого атомів Карбону, а між другим та третім атомами Карбону утворюється подвійний зв'язок.
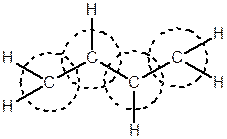
|
Така взаємодія двох сусідніх p -зв’язків називається спряженням (pp -спряженням), а його прояв – ефектом спряження. У молекулі утворюється єдина, спільна для усієї молекули p -електронна хмара з найбільшою електронною густиною між 1-2 та 3-4 атомами.
→ СН2(СІ) - СН=СН - СН2(СІ) - 1, 4 дихлорбутен-2
СН2 = СН - СН = СН2 + СІ2 —
→ СН2(СІ) - СН(СІ) - СН =СН2 - 1, 2 дихлорбутен-3
Окремі представники. Дивініл (1, 4-бутадієн), ізопрен (2-метил-1, 3-бутадієн).
Поняття про високомолекулярні сполуки, натуральні та синтетичні каучуки.
Продукти полімеризації спряжених дієнів називають синтетичними каучуками. Натуральний каучук - природний ненасичений стереорегулярний полімер ізопрену в цис -формі з молекулярною масою від 15000 до 500000, який добувається з соку тропічних дерев. Вперше синтетичний каучук у промисловому масштабі добуто в Росії за способом С.В. Лебедєва, який запропонував одержання бутадієнового каучуку за допомогою р-ції полімеризації бутадієну за наявності каталізатора - металевого натрію.
АЛКІНИ
Лекція № 4 (2 години)
План
1. Загальна характеристика гомологічного ряду алкінів.
2. Будова, ізомерія, номенклатура алкінів.
3. Способи добування алкінів.
4. Фізичні властивості.
5. Хімічні властивості.
6. Окремі представники, похідні, їх значення і використання.
Ключові слова: алкіни, потрійний зв'язок, етин, алкініли, реакція Кучерова, реакція А.Е. Фаворського, поляризація зв’язку, ацетиленіди, димеризація, купрен, полімеризація, вінілацетилен, синтетичний каучук, штучна шкіра.
Література: [1] с. 54 - 62; [3] с. 167 – 175
1.Загальна характеристика гомологічного ряду алкінів
Алкіни – ненасичені вуглеводні, в молекулах яких атоми Карбону сполучені потрійним зв’язком. Загальна формула сполук 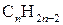 .
.
2. Будова, ізомерія та номенклатура алкінів
Будова (стан sp- гібридизації). Потрійний ковалентний зв’язок – сполучення σ - та двох π - зв’язків. Ізомерія алкінів обумовлена будовою карбонового ланцюгу та положенням потрійного зв’язку. Номенклатура. Ненасичені радикали – алкініли.
3. Способи добування алкінів
Одержання етину з карбіду кальцію:
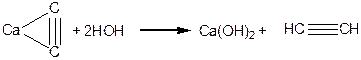
|
Способи одержання алкінів: дегідрогалогенування дигалогенопохідних алканів; алкілування ацетиленідів.
4. Фізичні властивості алкінів
Закономірності зміни фізичних властивостей в гомологічному ряду і залежно від структури ізомерів.
5. Хімічні властивості алкінів
Хімічні властивості алкінів обумовлені наявністю в їх молекулах потрійного зв’язку.
Реакції приєднання
Реакції електрофільного приєднання 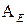 : водню, галогенів, галогеноводнів, води (реакція Кучерова), спиртів (реакція А.Е. Фаворського). Для алкінів реакції приєднання перебігають у дві стадії.
: водню, галогенів, галогеноводнів, води (реакція Кучерова), спиртів (реакція А.Е. Фаворського). Для алкінів реакції приєднання перебігають у дві стадії.
Реакція знебарвлення бромної води – якісна реакція на потрійний зв’язок.
Реакції окиснення
В результаті окиснення етину під дією водного розчину калій перманганату 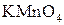 утворюється калієва сіль етандіової кислоти:
утворюється калієва сіль етандіової кислоти:
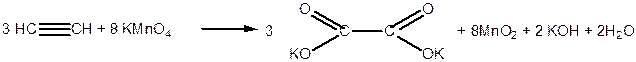
|
Наведену реакцію використовують як якісну реакцію на потрійний зв’язок.
Під дією сильних окисників в молекулі алкінів відбувається розрив карбонового ланцюга за місцем потрійного зв’язку, в результаті чого утворюються карбонові кислоти.
На повітрі ацетилен горить кіптявим полум’ям, під дією кисню – сліпучим полум’ям із виділенням великої кількості тепла.
Специфічні реакції
Для алкінів характерні реакції заміщення, що обумовлено значною поляризацією ≡ С-Н зв’язку.
Утворення металевих похідних — ацетиленідів:
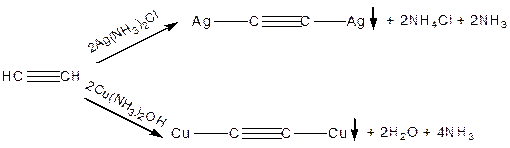
|
Це якісні р-ції на атом Гідрогену, що знаходиться біля Карбону з потрійним зв’язком. Їх використовують для виділення алкінів з суміші. Після осадження і виділення ацетиленідів під дією мінеральних кислот знову утворюються алкіни.
Реакції полімеризації
Полімеризація ацетилену: утворення вінілацетилену, бензолу, циклооктатетраєну, купрену.
6. Окремі представники, їх значення та використання
Промислове застосування ацетилену: добування оцтового альдегіду, синтетичного каучуку, штучної шкіри тощо. Використання ацетилену для різання і зварювання металів.
АЛІЦИКЛІЧНІ ВУГЛЕВОДНІ. ТЕРПЕНИ
(На самостійне опрацювання)
План лекції:
1. Загальна характеристика гомологічного ряду циклоалканів.
2. Будова, ізомерія, номенклатура циклоалканів.
3. Поширення у природі, способи добування циклоалканів.
4. Фізичні та хімічні властивості циклоалканів.
5. Теорія напруження А.Байєра.
6. Окремі представники, їх значення та використання.
Ключові слова: циклоалкани, стійкість циклів, теорія напруження А.Байєра, конформаційна ізомерія, кутове напруження, форма «ванни», форма «крісла», терпени, ефірна олія, моноциклічних терпени, біциклічні терпени.
Література: [2] с. 176 - 185; [1] с. 63 – 74
1. Загальна характеристика гомологічного ряду циклоалканів
Циклоалкани – вуглеводні циклічної будови, молекули яких містять замкнені цикли (кільця) з атомів Карбону, сполучених між собою ординарними зв’язками. Загальна формула циклопарафінів 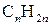 . За властивостями вони близькі до аліфатичних вуглеводнів, тому в назві мають аналогічний префікс
. За властивостями вони близькі до аліфатичних вуглеводнів, тому в назві мають аналогічний префікс 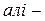 .
.
Аліциклічні сполуки можуть бути насиченими (циклоалкани) чи ненасиченими (циклоалкени і циклоалкадієни) залежно від відсутності або наявності подвійного зв’язку.
2. Будова, ізомерія та номенклатура циклоалканів
Будова (стан 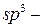 гібридизації, тип зв’язків, їх напрямленність). Структурна ізомерія обумовлена розміром циклу; ізомерією радикалів в циклі; ізомерією за положенням радикалів в циклі. Просторова ізомерія обумовлена різним просторовим розміщенням замісників відносно площини кільця.
гібридизації, тип зв’язків, їх напрямленність). Структурна ізомерія обумовлена розміром циклу; ізомерією радикалів в циклі; ізомерією за положенням радикалів в циклі. Просторова ізомерія обумовлена різним просторовим розміщенням замісників відносно площини кільця.
За міжнародною номенклатурою назви циклопарафінів утворюють від назв відповідних (за числом атомів Карбону) насичених вуглеводнів, додаючи префікс — 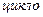 -: циклопропан, циклобутан і т.д. Нумерацію проводять таким чином, щоб замісники отримували найменші номери. Із метою спрощення написання формул циклічні сполуки умовно зображують у вигляді геометричних фігур, в яких число кутів відповідає числу атомів Карбону в циклі (трикутник, п’ятикутник тощо).
-: циклопропан, циклобутан і т.д. Нумерацію проводять таким чином, щоб замісники отримували найменші номери. Із метою спрощення написання формул циклічні сполуки умовно зображують у вигляді геометричних фігур, в яких число кутів відповідає числу атомів Карбону в циклі (трикутник, п’ятикутник тощо).
3. Поширення у природі, способи добування циклоалканів
Циклоалкани розповсюджені в природі - вони є головною складовою частиною деяких видів нафти, а також зустрічаються в ефірних оліях.
Способи добування: одержання із дигалогенопохідних алканів, гідрування ароматичних вуглеводнів, піроліз солей двохосновних кислот.
4.Фізичні та хімічні властивості циклоалканів
Для циклоалканів спостерігаються тіж самі закономірності в зміні фізичних властивостей як і для інших вуглеводнів.
Найпростіші циклоалкани — гази (циклопропан, циклобутан), а вищі — рідини або тверді речовини. Температура кипіння і густина у циклоалканів декілька вищі, ніж у їх аліфатичних аналогів із відповідним числом атомів Карбону. Циклоалкани малополярні і практично нерозчинні у воді.
Хімічні властивості циклоалканів значною мірою залежать від стійкості їх циклів. Так, циклопропану і циклобутану характерна підвищена реакційна здатність, вони легко вступають в реакції приєднання з розривом циклу і за властивостями нагадують алкени. Але вони не знебарвлюють бромну воду й розчин калій перманганату.
Вуглеводні з циклами з п’яти й більше атомами Карбону більш стійкі, для них подібно насиченим алканам характерні реакції заміщення.
1. Реакції приєднання
До реакцій приєднання у першу чергу схильні циклопропан і циклобутан.
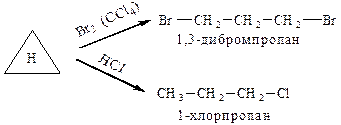
| |
| циклопропан |
2. Реакції заміщення
Реакції заміщення більше характерні для п’яти-, шестичленних і вищих циклів, які подібно алканам вступають до реакції заміщення в основному за радикальним механізмом.
3. Гідрування циклоалканів
На прикладі реакції гідрування нижчих моноциклоалканів за однакових умов, крім температури, наочно спостерігається відносна стійкість циклів та їх здатність до реакцій приєднання:
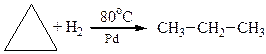
|
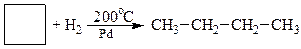
|
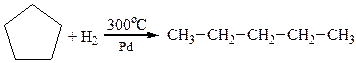
|
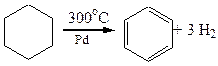
|
4. Реакції окиснення
Циклоалкани досить стійкі до дії окисників, а умови перебігу, напрямок і результат окиснення визначаються їх будовою. Із наведених реакцій видно, що хімічна поведінка циклоалканів тісно пов’язана з розмірами циклів.
5. Теорія напруження А.Байєра (1885 р.)
Передумовою сучасного трактування будови циклічних сполук була теорія напруження А.Байєра, який виходив із їх плоскої будови і пояснював стійкість циклів відхиленням їх валентних кутів від тетраедричного кута 109°28¢ у метані.
Із посилки — всі атоми в циклі розміщені в одній площині слідувало, що валентні кути в 3-членному циклі дорівнюють 60°, в 4-членному — 90°, в 5-членному — 108°, в 6-членному — 120° і т.д.
Чим більше відхилення валентного кута у циклі від кута в тетраедрі, тим більше напруження і менша стійкість циклу. Мірою напруження Байєр запропонував вважати половину різниці між кутом в тетраедрі і валентним кутом того чи іншого циклу (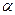 ):
):
| Циклопропан | 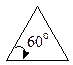
| 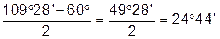
|
| Циклобутан | 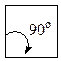
| 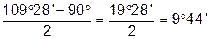
|
| Циклопентан | 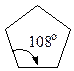
| 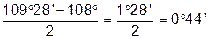
|
| Циклогексан | 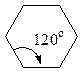
| 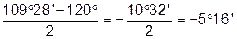
|
| Циклогептан | 
| 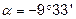
|
Як видно з наведених розрахунків найменше відхилення валентних зв’язків спостерігається у циклопентану, тому його кільце має незначну напругу. Воно міцніше, ніж кільця 3- та 4-членних циклів. Таким чином, теорія напруження пояснювала причину нестійкості 3- та 4-членних циклів, але не допускала можливості існування стійких вищих циклів, в яких напруження повинно бути великим. Ружечка добув стійкий циклогептадекан  , який витримував нагрівання до 400°С. Пояснення цей факт отримав після відкриття конформаційної — поворотної ізомерії органічних сполук.
, який витримував нагрівання до 400°С. Пояснення цей факт отримав після відкриття конформаційної — поворотної ізомерії органічних сполук.
Конформаційна (поворотна) ізомерія є результатом не досить вільного (обмежено вільного) обертання груп атомів молекули навколо 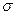 -зв’язків і зумовлює існування конформаційних ізомерів. Конформаційні ізомери – стереоізомери, які мають неоднакове просторове розміщення атомів або атомних груп, зумовлене обертанням навколо ординарного карбон-карбонового зв’язку. Ці ізомери називають ще конформірами або конформаціями. Конформація – різне просторове розташування атомів або груп атомів в молекулах певної конфігурації, зумовлене обертанням навколо
-зв’язків і зумовлює існування конформаційних ізомерів. Конформаційні ізомери – стереоізомери, які мають неоднакове просторове розміщення атомів або атомних груп, зумовлене обертанням навколо ординарного карбон-карбонового зв’язку. Ці ізомери називають ще конформірами або конформаціями. Конформація – різне просторове розташування атомів або груп атомів в молекулах певної конфігурації, зумовлене обертанням навколо 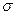 -зв’язків. Конформації мають різний запас вільної енергії, і звідси, є неоднакова вірогідність існування молекули у вигляді тої чи іншої конформації.
-зв’язків. Конформації мають різний запас вільної енергії, і звідси, є неоднакова вірогідність існування молекули у вигляді тої чи іншої конформації.
Г.Закс (1890 р.) і Е.Мор (1918 р.) припустили існування в циклах певних просторових неплоских побудов, що нині підтверджено різними фізичними методами. На поведінку складних циклів значний вплив має будова поворотних ізомерів.
Розглянемо поворотну ізомерію циклів на прикладі циклогексану. Атоми Карбону в циклогексані можуть розміщуватися в різних площинах у просторі і не змінюють валентних кутів атома Карбону. Для циклогексану можливе існування двох просторових форм (конформацій) без кутового напруження — форми “C” — [це] або “ванни” (човна) і форми “Z” — [зет] або “крісла”. Більш енергетично вигідною є форма “Z” — “крісла”, вона на 28, 9 кДж/моль (5 ккал/моль) менша.
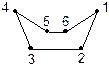
| 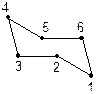
|
| Форма “C” — “ванни” | Форма “Z” — “крісла” |
У конформації “ванна” чотири атоми Карбону (2, 3, 5, 6) лежать в одній площині, а два (1, 4) — піднімаються над нею. А в конформації “крісло” атоми 1 або 4 опущені вниз, за площину, де знаходяться чотири (2, 3, 5, 6) атоми Карбону.
6. Окремі представники, їх значення та використання
Уявлення про циклоалкени, циклоалкадієни.
Терпени складають значну частину рослинних речовин, що входять до складу ефірних олій. Ефірні олії — рідини, що мають специфічний запах, нерозчинні у воді, але леткі з водяною парою. До ефірних олій відносяться: м’ятна, лимонна, гвоздична, трояндова та інші олії; скипидар — соснова ефірна олія. Їм притаманний специфічний запах, вони широко використовуються в парфумерній і харчовій промисловості.
В основі будови моноциклічних терпенів лежить вуглеводень С10 Н20 - ментан (1-метил-4-ізопропілциклогексан). В лимонній олії та скипидарі міститься один з простіших моноциклічних терпенів лимонен. Ментол належить до числа важливих кисневих моноциклічних терпенів. Має слабкі антисептичні властивості. Використовується в медицині.
Серед біциклічних похідних особливе значення має α -пінен і камфора. α -Пінен - рідина, tкип.=156оС. Він є основною складовою частиною скипидару, має запах соснової хвої. Використовується як розчинник лаків і фарб. Камфора використовується як ліки, а також як пластифікатор при одержанні целюлози.
АРОМАТИЧНІ ВУГЛЕВОДНІ
Лекція №5 (2 години)
План
1. Загальна характеристика класу аренів.
2. Будова, ізомерія, номенклатура одноядерних аренів.
3. Природні джерела та способи добування аренів.
4. Фізичні властивості ароматичних вуглеводнів.
Ключові слова: ароматичні вуглеводні, одноядерні арени, бензол, ароматичний зв'язок, бензольне ядро, шестиелектронний π -зв’язок, орто-, мета-, пара- ізомери, ароматизація нафти, канцерогенні речовини.
Література: [1] с. 75 - 83; [3] с. 185 – 192
1. Загальна характеристика класу аренів
Арени – вуглеводні, в молекулах яких міститься циклічне угрупування (бензольне кільце), атоми Карбону якого сполучені між собою ароматичним зв’язком. Найпростішим представником аренів є бензол С6Н6.
Класифікація аренів: одноядерні та багатоядерні ароматичні вуглеводні, які мають два або більше бензольних кілець.
2. Будова, ізомерія, номенклатура одноядерних аренів
Будова бензолу в світі сучасних уявлень про природу хімічних зв’язків. Сучасна структурна формула бензолу.
Молекула бензолу має форму правильного плоского шестикутника. Усі атоми Карбону в бензольному циклі знаходяться в стані sp2-гібридизації. Кожний з них утворює три звичайних σ -зв’язки (за рахунок трьох гібридних орбіталей), які розташовані у просторі під кутом 120о. Негібридизовані р-орбіталі кожного атома Карбону орієнтовані перпендикулярно до площини бензольного кільця і перекриваються між собою над і під кільцем. В результаті виникає спільна електронна хмара і утворюється єдиний хімічний π -зв’язок для всіх атомів Карбону. Таким чином, шість π -електронів не локалізовані в пари, а утворюють єдину π -систему.
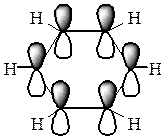
| 
|
Таким чином, молекула бензолу - стійкий симетричний шестичленний цикл з однаковими СН-групами, які знаходяться в одній площині і зв’язані ароматичною системою зв’язків.
Гомологи бензолу. Ізомери двозаміщених аренів: орто -, мета -, пара - ізомери).
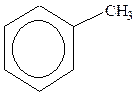
| 
| 
| 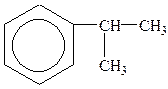
|
| толуол | о-ксилол | стирол (вінілбензол) | кумол (ізопропілбензол) |
3. Природні джерела та способи добування аренів
Природні джерела ароматичних сполук: кам’яновугільна смола, коксовий газ. Арени також одержують ароматизацією нафти (каталітичне дегідрування циклоалканів, дегідроциклізація алканів).
Синтез гомологів бензолу можна здійснювати за реакціями Вюрца-Фіттіга, Фріделя-Крафтса, тримеризації ацетилену, лужного сплавлення солей ароматичних кислот.
Синтез Вюрца-Фіттіга (1864 р.):
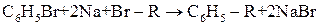
| |
| Бромбензол | Алкілбензол |
Реакція Фріделя-Крафтса:
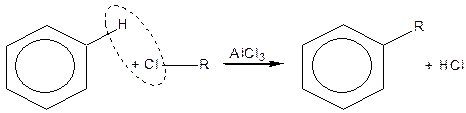
| |
| Бензол | Алкілбензол |
Сплавлення солей ароматичних кислот з лугами
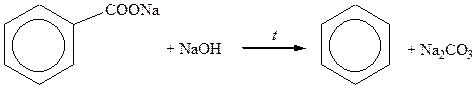
|
4. Фізичні властивості ароматичних вуглеводнів
Арени – малополярні сполуки і їхні фізичні властивості аналогічні властивостям аліфатичних вуглеводнів, які залежать від розміру та ізомерії замісників. Бензол та його найближчі гомологи – безбарвні рідини з характерним запахом, вищі гомологи – тверді речовини. Вони нерозчинні у воді, але добре розчиняються в органічних розчинниках. Легко загоряються і горять світним, сильно кіптявим полум’ям. Рідкі арени самі є гарними розчинниками органічних сполук. Пари та рідини токсичні, деякі речовини – канцерогенні.
ВЛАСТИВОСТІ АРЕНВ. БАГАТОЯДЕРНІ АРОМАТИЧНІ СПОЛУКИ
Лекція №6 (2 години)
План
1. Хімічні властивості аренів.
2. Окремі представники, похідні, їх значення і використання.
3. Арени з конденсованими циклами, їх будова, хімічні властивості.
4. Багатоядерні сполуки з неконденсованими циклами, їх будова, хімічні властивості.
Ключові слова: реакції електрофільного заміщення, замісники першого роду, замісники другого роду, орієнтуюча дія, багатоядерні арени, конденсовані цикли, нафталін, антрацен, фенатрен, ізольовані бензольні цикли, дифеніл.
Література: [1] с 75 – 110; [3] с. 185 - 209; [13]
1. Хімічні властивості аренів
Реакції електрофільного заміщення 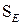 (алкілування, галогенування, нітрування, сульфування та ацилування) та їх механізм.
(алкілування, галогенування, нітрування, сульфування та ацилування) та їх механізм.
Правила заміщення в бензольному кільці. Якщо в бензольному ядрі є замісник, тоді інший замісник займає положення, яке залежить від характеру першого. Всі замісники за характером їх орієнтуючої дії поділяють на дві групи.
Замісники першого роду – галогени, вуглеводневі радикали, гідроксильна і заміщена гідроксильна група, аміно- і заміщена аміногрупа – є орто -, та пара -орієнтантами. Замісники другого роду – карбоксильна група, альдегідна, сульфо-, нітро- групи та інші – мета- орієнтанти.
Орієнтуюча дія замісників пояснюється їх різним впливом на реакційну здатність бензольного ядра. Замісники першого роду (крім галогенів) збільшують електронну густину бензольного ядра і таким чином активізують й поляризують його, в результаті чого на атомах Карбону в орто - і пара -положеннях виникає частково від’ємний заряд. Реакції заміщення прискорюються. Замісники другого роду зменшують електронну густину ядра і менше за все на атомах Карбону в мета -положеннях, внаслідок чого це положення стає найбільш реакційно здатним.
Вплив замісників на бензольне кільце.
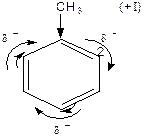
| 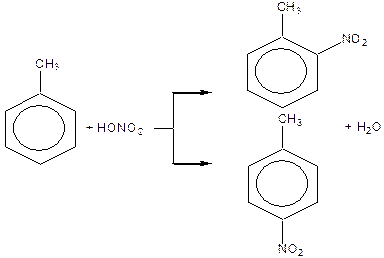
|
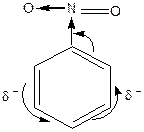
| 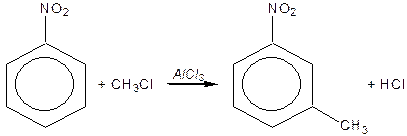
|
Необхідно відмітити, що ці правила не мають абсолютного значення. У більшості
реакцій поряд з переважною кількістю основного продукту реакції (згідно з правилами) утворюються й інші ізомери, в значно меншій кількості.
Реакції приєднання: гідрування, фотохімічне хлорування.
Окиснення бензолу та його гомологів
Бензол дуже стійкий до окисників. За звичайних умов він не знебарвлює розчин калій перманганату  .
.
В умовах дії окисників на гомологи бензолу окисненню піддається боковий ланцюг, який під час окиснення «згоряє», за виключенням найближчого до ядра атому Карбону, що окиснюється до карбоксильної групи:
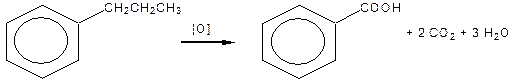
|
| Бензойна кислота |
2. Окремі представники, їх значення та використання
Бензол, толуол, ксилоли, кумол та стирол.
3. Багатоядерні арени з конденсованими циклами, їх будова, хімічні властивості.
Нафталін, фенантрен, антрацен. Їх будова, хімічні властивості
(гідрування, електрофільне зміщення, окиснення).
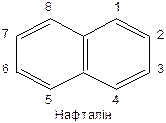
|
Положення 1, 4, 5, 8 – a -положення; положення 2, 3, 6, 7 – b -положення.
Нафталін виявляє ароматичний характер у реакціях заміщення (галогенується, нітрується, сульфується), які відбуваються як правило в a -положенні.
Гідрування нафталіну з утворенням тетраліну і декаліну.
Окиснення нафталіну відбувається легше, ніж бензолу. У цьому випадку одне з бензольних ядер руйнується, а його a -карбонові атоми перетворюються на карбоксильні групи. Проміжним продуктом є a -нафтохінон.
Антрацен, фенантрен виявляють ароматичний характер, легко вступають також у реакції приєднання. Надактивними є положення 9, 10 (мезо -).

|
Альфа — (1, 4, 5, 8), бета — (2, 3, 6, 7), мезо — (9, 10)

|
| Фенантрен |
Сам фенантрен не становить практичного інтересу, але багато складних природних сполук, які мають фізіологічне значення, містять фенантренове кільце. Це стероїди, полові гормони, вітамін D, алкалоїди тощо.
Вуглеводні з багатьма конденсованими бензольними ядрами. Поняття про канцерогенні вуглеводні.
4. Багатоядерні арени з ізольованими бензольними ядрами, їх будова, хімічні властивості.
Найпростішою сполукою цієї групи є дифеніл:
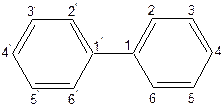
|
Дифеніл — речовина ароматичного характеру, легко нітрується, сульфується (реакції 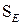 ) з утворенням головним чином пара -ізомерів.
) з утворенням головним чином пара -ізомерів.
Прикладами аренів з ізольованими ядрами є дифенілметан і трифенілметан.
Дифенілметан має приємний запах, подібний запаху апельсину, внаслідок чого його використовують в парфумерії. Аміно- й оксипохідні трифенілметану є відомими барвниками - малахітовий зелений, кристалічний фіолетовий тощо.
Змістовий модуль 2 Основні класи органічних сполук
ГІДРОКСИСПОЛУКИ. СПИРТИ
Лекцїя № 7 (2 години)
План
1. Загальна характеристика гідроксисполук.
2.Будова, ізомерія, номенклатура одноатомних спиртів.
3.Способи добування одноатомних спиртів.
4. Фізичні властивості спиртів.
5. Хімічні властивості одноатомних спиртів.
6. Окремі представники, їх значення і використання.
Ключові слова: гідроксисполуки, одноатомні спирти, функціональна група, гідроксильна група, водневий зв'язок, асоціація, контракція спирту, алкоголяти, етери, естери, дегідрування, багатоатомні спирти, дегідратація.
Література: [1] с. 111 - 123; [3] с. 227 – 246
Загальна характеристика гідроксисполук
Спирти - похідні вуглеводнів, в молекулах яких один або декілька атомів Гідрогену заміщені гідроксильними групами. Класифікація спиртів залежно від природи радикала та кількості гідроксильних груп. Насичені одноатомні спирти.
2. Будова, ізомерія, номенклатура одноатомних спиртів
Алканоли – одноатомні спирти. Первинні, вторинні, третинні спирти.
3. Способи добування одноатомних спиртів
Способи добування: приєднання води до алкенів (гідратація); гідроліз галогенопохідних вуглеводнів; відновлення карбонільних сполук; бродіння вуглеводів та ін.
4. Фізичні властивості одноатомних спиртів
Загальні зміни фізичних властивостей (густина, температури кипіння й плавлення тощо), характерні для вуглеводнів, проявляються і в спиртах. Але їх температури кипіння суттєво вищі, ніж алканів і галогеналканів з тією самою кількістю атомів Карбону. Це пояснюється наявністю водневих зв’язків, які сприяють існуванню асоціатів між молекулами спирту (так само, як і для води):
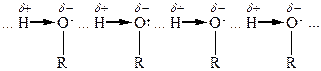
|
Залежно від будови первинні спирти мають вищу температуру кипіння, ніж вторинні, які, у свою чергу, характеризуються більшою температурою кипіння порівняно з третинними.
Контракція спирту.
5. Хімічні властивості одноатомних спиртів
Хімічні властивості спиртів обумовлені наявністю функціональної групи -ОН. Електронний характер гідроксильної групи визначає її здатність до реакцій гетеролітичного типу, внаслідок яких може розриватися або зв’язок С-О, або О-Н.
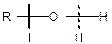
|
Отже, спирти, як і вода, виявляють амфотерні властивості, хоча і дуже слабкі. Спирти — нейтральні речовини, не змінюють забарвлення лакмусу, не реагують ні з розведеними кислотами, ні з розведеними основами.
Кислотні властивості
Визначаються легкістю відриву Н+ від гідроксигрупи. Спирти активно реагують із лужними металами, менш активно — із лужноземельними, магнієм і алюмінієм. Ці реакції відносяться до реакцій заміщення —виділяється водень і утворюються солі — алкоголяти (алканоати):
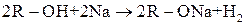
Алкоголят Na
Як солі слабких кислот і сильних основ, алкоголяти гідролізуються у розчині, створюючи лужне середовище:
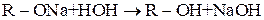
Основні властивості
Спирти взаємодіють із сильними кислотами:
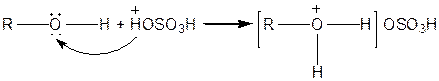
|
| Сіль алкілгідроксонію |
Такі солі нестійкі.
Реакції заміщення гідроксигрупи на галоген
Дія галогеноводнів на спирти — одна з найважливіших реакцій нуклеофільного заміщення:
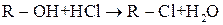
Заміщення гідроксилу на галоген відбувається і в умовах дії наступних сполук: 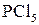 ,
, 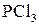 ,
, 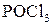 ,
, 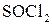 . Найлегше реагують третинні спирти.
. Найлегше реагують третинні спирти.
Утворення етерів
Утворення етерів (простих ефірів) відбувається за рахунок відщеплення молекули води від двох молекул спирту в умовах нагрівання і у присутності водовіднімаючих засобів:
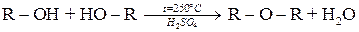
За більш м’якими умовами реакція утворення етерів перебігає внаслідок взаємодії алкоголята з галогеналканом.
Утворення естерів
Естери (складні ефіри) утворюються під час взаємодії кислоти і спирту. Наприклад,
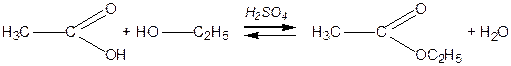
| ||
| Оцтова кислота | Етанол | Етилацетат |
Окиснення спиртів
Якщо спирт підпалити, він згоряє з утворенням води та вуглекислого газу:
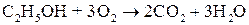
Під дією інших окисників (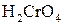 ;
; 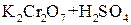 ;
; 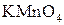 ;
;  ) спирти окиснюються і утворюють різні продукти: первинні спирти окиснюються до альдегідів, вторинні спирти - до кетонів, окиснення третинних спиртів супроводжується розривом карбонового ланцюга, як правило, біля атому Карбону, що має гідроксильну групу.
) спирти окиснюються і утворюють різні продукти: первинні спирти окиснюються до альдегідів, вторинні спирти - до кетонів, окиснення третинних спиртів супроводжується розривом карбонового ланцюга, як правило, біля атому Карбону, що має гідроксильну групу.
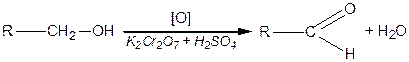
|
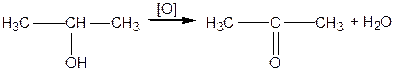
|
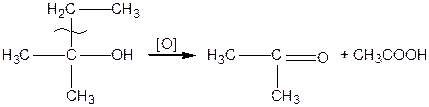
|
Дегідрування спиртів
Дегідрування спиртів відбувається під час пропускання пари спирту над дегідруючим каталізатором (розжарена мідь, залізо, нікель). У цьому випадку первинні спирти перетворюються на альдегіди, вторинні — на кетони.
Дегідратація спиртів
Дегідратація спиртів у залежності від умов може бути внутрішньомолекулярною (утворення олефінів) і міжмолекулярною (утворення етерів).
6. Окремі представники, їх значення і використання
Метанол, етанол, пропілові, бутилові, вищі жирні спирти.
НЕНАСИЧЕНІ СПИРТИ. БАГАТОАТОМНІ СПИРТИ
Лекцїя № 8 (2 години)
План
1. Ненасичені одноатомні спирти.
2. Багатоатомні спирти, їх будова, ізомерія, номенклатура.
3. Способи добування багатоатомних спиртів.
4. Фізичні та хімічні властивості багатоатомних спиртів.
5. Окремі представники багатоатомних спиртів, їх значення
і використання.
Ключові слова: ненасичені спирти, полімеризація, вініловий спирт, полівінілацетат,, багатоатомні спирти, гліцерати, дегідратація, діоксан, акролеїн.
Література: [1] с. 123 - 135; [3] с. 246 – 256
1. Ненасичені одноатомні спирти
Ненасичені одноатомні спирти – можуть бути етиленового (алкеноли) або ацетиленового (алкіноли) ряду. Найважливіше значення мають спирти етиленового ряду. Одержання етерів та естерів вінілового спирту 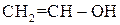 з ацетилену:
з ацетилену:
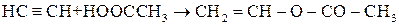
Такі сполуки мають подвійний зв’язок і легко полімеризуються:
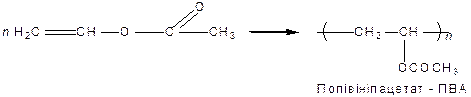
|
2. Багатоатомні спирти, їх будова, ізомерія, номенклатура
Багатоатомні спирти — гідроксисполуки, молекулах яких містять дві та більш гідроксильні групи: двоатомні (діоли); триатомні (триоли) тощо. Спирти, які б мали дві або три гідроксигрупи біля одного атому Карбону нестійкі, виділити їх неможливо.
3. Способи добування багатоатомних спиртів
гідроліз відповідних дигалогенопохідних;
реакція Вагнера;
гідроліз жирів.
4. Фізичні та хімічні властивості багатоатомних спиртів
Багатоатомним спиртам характерні властивості одноатомних спиртів, але відповідні реакції відбуваються як за однією, так і за іншими гідроксигрупами. Взаємний вплив гідроксигруп посилює рухливість їх атомів Гідрогену, внаслідок чого багатоатомні спирти мають більш виражені кислотні властивості ніж одноатомні спирти. Вони реагують не тільки з металічним натрієм, а й з лугами, розчиняють осад 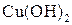 , утворюючи комплексну сполуку Купруму – Купрум(ІІ) гліколят — розчин темно-синього кольору.
, утворюючи комплексну сполуку Купруму – Купрум(ІІ) гліколят — розчин темно-синього кольору.
Це якісна реакція на багатоатомні спирти:
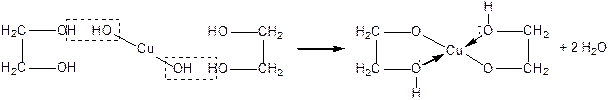
|
Дегідратація спиртів залежить від будови гліколю та умов реакції:
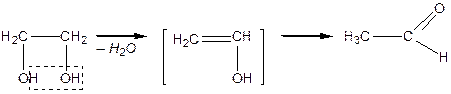
|
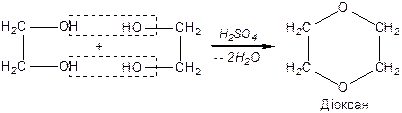
|
Поліконденсація гліколю:
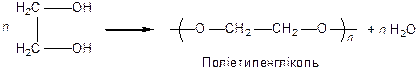
|
Дією на гліцерин водовіднімаючих засобів або нагріванням добувають ненасичений альдегід — акролеїн із характерним запахом горілого жиру:
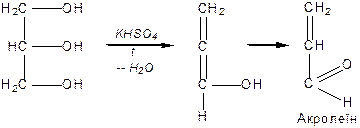
|
5. Окремі представники, їх значення та використання
Етиленгліколь утворює незамерзаючі за низьких температур водні й спиртові розчини — антифрізи, що заміняють воду в радіаторах двигунів; використовується для синтезу лавсану тощо.
Гліцерин утворює естери як з мінеральними кисневмісними кислотами, так і з органічними. Важливим продуктом є азотнокислий ефір гліцерину (нітрогліцерин), який використовується в медицині, для виготовлення динаміту. Використання гліцерину: у медицині, текстильній, харчовій промисловості, для виробництва пластмас (гліфталеві смоли).
Поняття про спирти вищої атомності. Ксиліт. Сорбіт.
ФЕНОЛИ
Лекція №9 (2 години)
План
1. Будова, ізомерія, номенклатура фенолів.
2. Поширення у природі та способи добування.
3. Фізичні та хімічні властивості фенолів.
4. Окремі представники, їх значення і використання.
5. Нафтоли.
Ключові слова: одноядерні феноли, крезол, кумольний спосіб, антисептичні властивості, поліконденсація, феноло-формальдегідна смола, хінон, перекисний радикал, антиоксиданти, поліфенольні сполуки, нафтоли.
Література: [1] с. 135 - 149; [3] с. 256 - 271
1. Будова, ізомерія, номенклатура фенолів
Феноли – похідні ароматичних вуглеводнів, у молекулах яких один або декілька атомів Гідрогену ароматичного ядра заміщені на гідроксильні групи, наприклад:
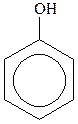
| 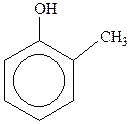
| 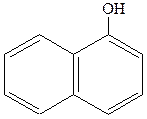
| 
|
| фенол (гідроксибензол) |  крезол ( крезол (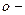 гідрокситолуол) гідрокситолуол)
| 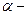 нафтол (1-нафтол або нафтол (1-нафтол або 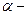 гідроксинафталін) гідроксинафталін)
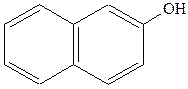
|  нафтол (2-нафтол або нафтол (2-нафтол або  гідроксинафталін) гідроксинафталін)
|
Залежно від кількості гідроксильних груп розрізняють одно-, дво-, триатомні тощо феноли.
Ізомерія фенолів зумовлена розташуванням гідроксигруп в ароматичній сполуці, будовою і положенням замісників. Назви фенолів утворюють із назв відповідних аренів, додаючи закінчення 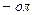 . Нумерацію атомів Карбону в ароматичному ядрі починають з атома, біля якого знаходиться гідроксигрупа. Та поряд із зазначеними багато фенолів зберегли тривіальні назви, які досі широко використовуються.
. Нумерацію атомів Карбону в ароматичному ядрі починають з атома, біля якого знаходиться гідроксигрупа. Та поряд із зазначеними багато фенолів зберегли тривіальні назви, які досі широко використовуються.
2. Поширення у природі та способи добування
Способи добування: із кам’яновугільної смоли; лужне сплавлення солей бензолсульфокислот; кумольний спосіб.
3. Фізичні та хімічні властивості фенолів
Одноатомні феноли – прозорі рідини або кристалічні речовини. У разі попаданні на шкіру викликають опіки. Фенол – отруйна речовина, має сильні антисептичні властивості.
Хімічні властивості фенолів та нафтолів обумовлені наявністю в їх молекулах гідроксигрупи та ароматичного ядра. Вони вступають у численні реакції, характерні для цих груп, а також у реакції, що зумовлені їх взаємним впливом. Але фенолам характерні більш виражені кислотні властивості, ніж спиртам. Це пояснюється тим, що шість електронів бензольного ядра, які утворюють єдину 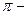 електронну систему, відтягують на себе електрони атому Оксигену гідроксильної групи, внаслідок чого електронна густина зв’язку
електронну систему, відтягують на себе електрони атому Оксигену гідроксильної групи, внаслідок чого електронна густина зв’язку 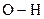 зміщується від атома Гідрогену до атома Оксигену, зв
зміщується від атома Гідрогену до атома Оксигену, зв
|
|