
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Одержання дисперсних систем
|
|
Дисперсні системи одержують шляхом подрібнення речовин – методи диспергування або шляхом об'єднання молекул та іонів у часточки колоїдного ступеню дисперсності – методи конденсації.
Механічне диспергування полягає у розмелюванні речовини дисперсної фази. Для цього застосовують млини різних типів. Електричне диспергування застосовують для добування ліофобних золів металів. Електроди з металу, золь якого мають добути, занурюють у рідину, зближують їх і пропускають електричний струм під напругою. Виникає " вольтова дуга". У зоні її дії від електродів відриваються часточки металу, які переходячи у рідке середовище утворюють золь. Ультразвукове диспергування вельми ефективний метод руйнування таких неміцних речовин, як крохмаль, желатин тощо. Механізм дії ультразвуку полягає у тому, що звукові хвилі створюють в об’ємі речовини порожнини, які почергово стикаються і розширюються, що призводять до руйнації і подрібнення матеріалу.
Конденсаційні методи поділяються на фізичні і хімічні. До фізичних відносять методи конденсації пари і заміни розчинника. Метод конденсації пари призводить до утворення аерозолів, якщо під час зниження температури тиск пари над рідиною стає вище її насиченого тиску. При цьому у газовій фазі виникає нова фаза – туман. Метод заміни розчинника призводить до утворення ліозолів, якщо до розчину додають інший розчинник, в якому розчинена речовина погано розчиняється. Метод хімічної конденсації зводиться до утворення під час перебігу хімічних реакцій малорозчинних речовин, молекули яких злипаються між собою, утворюючи колоїдні часточки.
Таблиця 17.1 – Класифікація дисперсних систем
| Дисперсна фаза | Дисперсійне середовище | Назва системи | Приклади |
| Г | Г | Гомогенна | Суміш газів, повітря |
| Г | Р | Рідка піна | Мильна або пивна піна |
| Газова емульсія | Газовані напої | ||
| Г | Т | Тверда піна | Зефір, пемза, хліб |
| Р | Г | Аерозоль | Туман, хмари |
| Р | Р | Емульсія | Молоко, крем |
| Р | Т | Тверда емульсія | Бісквіт, вологий ґрунт |
| Т | Г | Аерозоль | Дим або пил у повітрі |
| Т | Р | Суспензія, золь | Пісок або мул у воді |
| Т | Т | Твердий золь | Сплави металів, емалі |
17.3 Методи очистки колоїдних розчинів
Золі часто містять небажані домішки, які призводить до їх руйнації. Існує декілька методів очистки золів від таких домішок.
Діаліз – це процес очищення золів від наявних у них низькомолекулярних сполук за допомогою напівпроникних мембран, крізь які вільно проходять молекули та іони, але затримуються більші за розміром часточки дисперсної фази. До недоліків процесу діалізу можна віднести низьку швидкість процесу очистки. Електродіаліз – процес очистки золів від електролітів. Електродіалізатор складається з трьох частин: двох бічних і однієї середньої, яку відокремлюють мембранами. У бічних частинах розміщені електроди і циркулює вода. Колоїдний розчин розміщують у середній частині, де знаходиться механічна мішалка. Під час проходження електричного струму іони, від яких очищують золь, переміщуються до відповідних електродів, проходять через мембрану і виносяться водою.
Мембрани застосовують також для поділу дисперсної системи на окремі фази, наприклад у процесах ультрафільтрації. Мембрани при цьому закріплюють на твердій поруватій підкладці у спеціальних ультрафільтрах Під фільтром створюють розрідження (ультрафільтрація під вакуумом) або діють тиском на золь (ультрафільтрація під тиском). На лекції надаються характеристики мембран, що застосовуються для очистки золів.
Лекція №18
Фізико-хімічні властивості дисперсних систем
План лекції
1. Молекулярно-кінетичні властивості золів. Броунівський рух, його природа.
2. Оптичні властивості золів. Розсіювання світла. Закон Релея. Ультрамікроскопія.
3. Електрокінетичні явища. Дослід Рейса. Електрофорез і електроосмос.
Рекомендована література: [1] С.503-506, 524-527, [2] С.104-107,
[3] С.125-132, 183-185.
18.1 Молекулярно-кінетичні властивості золів
Броунівський рух являє собою хаотичний рух часточок дисперсної фази в золях. Він властивий будь-яким часточкам: чим вони менші, тим він інтенсивніший. Велика часточка одержує мільярди ударів молекул за секунду з усіх боків, внаслідок чого більшість ударів взаємно компенсуються. Теорію броунівського руху розробили Ейнштейн і Смолуховський.
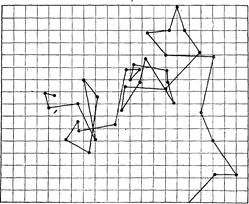 Точний шлях переміщення часточки в золях встановити неможливо: за 1 с часточка змінює напрям свого руху до 1012 разів. У своїх теоріях автори замість швидкості руху часточки застосували поняття " зсув часточки " – відрізок прямої, який з’єднує вихідну точку руху часточки з її положенням у момент часу t (через 1...3 с) на площині горизонтальної проекції, що спостерігають у мікроскоп. На рис. 18.1. показана діаграма броунівського руху колоїдних часточок.
Точний шлях переміщення часточки в золях встановити неможливо: за 1 с часточка змінює напрям свого руху до 1012 разів. У своїх теоріях автори замість швидкості руху часточки застосували поняття " зсув часточки " – відрізок прямої, який з’єднує вихідну точку руху часточки з її положенням у момент часу t (через 1...3 с) на площині горизонтальної проекції, що спостерігають у мікроскоп. На рис. 18.1. показана діаграма броунівського руху колоїдних часточок.
Рисунок 18.1 – Діаграма броунівського руху
Для часточок сферичної форми середній зсув розраховують за рівнянням Ейнштейна-Смолуховського:
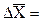
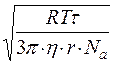 , (18.1)
, (18.1)
де h – в’язкість дисперсійного середовища; r – радіус часточок; Nа – число Авогадро; R – універсальна газова стала; Т – абсолютна температура.
Користуючись рівнянням (18.1) визначають розміри часточок золю.
Дифузія в золях – це самочинний процес вирівнювання концентрації часточок золю унаслідок їх броунівського руху. Рівняння, що зв’язує середній зсув часточок під час броунівського руху і швидкість їх дифузії, має вигляд:
 . (18.2)
. (18.2)
Швидкість дифузії – це величина обернено пропорційна розмірам часточок. Таким чином, у золях, де розміри часточок значно більші ніж розміри молекул, інтенсивність дифузії у тисячі разів менша, ніж у розчинах. У розчинах коефіцієнти дифузії – D мають значення ~10–5...10–6, а у золях ~10–7...10–8 см2/с.
18.2 Оптичні властивості золів
Під час проходження світла через дисперсні системи має місце розсіювання світла – тобто зміна променями світла свого початкового напрямку унаслідок огинання променями часточок дисперсної фази. Дослідив явище розсіювання світла Тиндаль, який спостерігав молочно-білий світловий конус, що з'являється у золях під час пропускання через них промінів світла. У розчинах розсіювання світла незначне, тому наявність такого конусу однозначно вказує на колоїдний ступень дисперсності часточок. Інтенсивність (яскравість) світла, розсіяного золями із сферичними часточками, визначають за рівнянням лорда Релея:
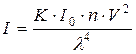 , (18.3)
, (18.3)
де І – інтенсивність розсіяного світла; І 0 – інтенсивність падаючого світла; К – коефіцієнт, який залежить від співвідношення показників заломлення дисперсної фази і дисперсійного середовища; V – об'єм часточки; n – концентрація часточок у золі; l – довжина хвилі падаючого світла.
Прилади, що вимірюють інтенсивність розсіяного світла, називаються нефелометрами. Найсильніше розсіюються короткі хвилі, тому розсіяне світло завжди блакитного кольору. З розсіюванням світла пов'язане явище опалесценції золів – появи каламутності і зміні забарвлення золів у відбитому світлі.
Для дослідження золів застосовують ультрамікроскопи, в яких освітлення об'єкту здійснюється збоку потужним потоком світла. Часточки золю спостерігаються при цьому як окремі цяточки, що світяться на темному фоні. В ультрамікроскопі спостерігають не саму часточку, а світло, що вона розсіює. Ультрамікроскопія дозволяє спостерігати рух часточок, визначати їх розмір, масу і концентрацію у золях. Чим менша довжина хвилі світла, що застосовується у мікроскопі, тим менші за розміром об’єкти можна спостерігати. В електронних мікроскопах на об’єкт спрямовують потік електронів, що дозволяє спостерігати об'єкти розміром 2...5 нм. Електронні мікроскопи дозволяють бачити молекули білків.
18.3 Електрокінетичні явища
Наявність електричних зарядів у часточок дисперсної фази була доказана проф. Рейсом за допомогою простого досліду. У шматок сирої глини він помістив дві заповнені водою скляні трубки і встановив туди електроди. Під час пропускання електричного струму в анодній трубці з’явилися часточки глини, а у катодній трубці підвищився рівень води. Рейс зробив висновок, що і часточки, і пористі тіла накопичують на своїй поверхні електричні заряди. Переміщення часточок золю в електричному полі називається електрофорезом. Перенос рідини крізь капілярно-поруваті тіла під дією електричного поля називають електроосмосом. Під час осідання часточок у золі між двома електродами, розташованими на різній висоті, виникає різниця потенціалів, яку називають потенціалом седиментації. Якщо рідина з певною швидкістю протікає через капіляр, на кінцях капіляру виникає різниця потенціалів, яка прагне запобігти такому руху рідини. Таку різницю потенціалів називають потенціалом протікання.
Лекція №19
Коагуляція і стабілізація ліофобних золів
План лекції
1. Будова міцел ліофобних золів. Електрокінетичний потенціал.
2. Коагуляція золів. Правила електролітної коагуляції. Ліотропні ряди іонів.
3. Захист золів від коагуляції. Пептизація.
Рекомендована література: [1] С.507-516, [2] С.108-113, [3] С.118-121, 132-128, [4] С.161-163.
19.2 Будова міцел ліофобних золів
Виникнення зарядів на часточках золю зумовлене адсорбцією іонів на їх поверхні. Часточки дисперсної фази називають міцелами. Міцела –це складний агрегат молекул і іонів. Розглянемо будову міцели золю AgJ, одержаного реакцією між розчинами AgNO3 та КJ. Рівняння реакції в іонній формі має такий вигляд: Ag+ + NO3– + K+ + J– = AgJ + NO3– + K+.
Якщо один з реагентів, наприклад КJ, узятий в надлишку, то він виконує роль стабілізатору золю. За таких умов тисячі молекул AgJ конденсуючись утворюють ядро міцели [ m AgJ], де m – число молекул, що злиплися. На поверхні ядра адсорбується n іонів J–, оскільки іони Ag+ у розчині відсутні. Іони J–, які щільно прилягають до ядра, називають потенціалвизначаючими. Вони притягають з розчину протилежно заряджені іони K+, які утворюють адсорбційний шар протиіонів – (n–x)K+. Ядро міцели і адсорбційний шар утворюють негативно заряджену гранулу: {[ m AgJ]× n J–× (n – x)К+}– x . Решта протиіонів – х K+ знаходиться на деякій відстані від поверхні гранули, утворюючи дифузійний шар протиіонів. Загалом міцела нейтральна, заряд несе на собі лише гранула. Одержана міцела має таку формулу: {[ m AgJ]× n J–× (n – x)К+}– x × х К+.
Якщо добути золь AgJ за тією ж обмінною реакцією, але за наявності у розчині надлишку AgNO3, роль потенціалвизначаючих іонів виконують іони Ag+. Міцела золю має такий вигляд: {[ m AgJ]× n Ag+× (n – x)NO3–}+ x × х NO3–.
На рис. 19.1 зображені схеми міцел золю AgJ.

Рисунок 19.1 – Будова міцел золю AgJ, добутого: а – за надлишку у розчині AgNO3; б – за надлишку у розчині КJ
Біля поверхні колоїдних часточок завжди виникає ПЕШ. Під час електрофорезу гранула разом з частиною протиіонів рухається до одного з електродів, а інші протиіони переміщуються до другого електроду. Швидкість руху часточки залежить від потенціалу на межі ковзання, що розділяє дві частини міцели, які взаємно переміщуються. Потенціал, що відповідає межі ковзання носить назву електрокінетичного потенціалу (дзета-потенціалу)– z.
19.2 Коагуляція золів
Процеси, що призводять до злипання часточок золю під дією міжмолекулярних сил називаються коагуляцією. Будь-яка зовнішня дія (нагрівання, збовтування) викликає коагуляцію золів. Початок коагуляції золю визначають у той момент, коли він каламутніє. Більшість золів здатна протидіяти коагуляції. Дифузійні шари міцел мають однаковий заряд, тому під час зближення часточки золю відштовхуються. Під час додання до золю електролітів у середовище поступають вільні іони. Товщина дифузного шару при цьому зменшується і починається коагуляція золю.
Дослідним шляхом були визначені правила електролітної коагуляції золів: усі електроліти без винятку здатні викликати коагуляцію золів; коагуляцію викликає іон з зарядом протилежним заряду гранули; для початку коагуляції необхідно, щоб концентрація електроліту перевищила мінімальну величину, яку називають порогом коагуляції. Здатність іонів до коагуляції посилюється при збільшенні їх заряду. Остання закономірність називають правилом Шульце-Гарді. Для аніонів залежність має такий вигляд: А-: А-2: А-3 = 1: 11: 729. Тобто кількість тривалентних аніонів, яку необхідно додати до золів для початку їх коагуляції у ~729 разів менше, ніж одновалентних. Досліди показали, що для іонів, які мають однакові заряди, здатність викликати коагуляцію золів посилюється із збільшенням їх радіусів. За цією ознакою вони розташовані у ліотропні ряди:
Li+ > Na+ > K+ > Rb+ > Cs+; Cl- > Br- > NO3- > J- > CNS-.
19.3 Захист золів від коагуляції
Підвищити стійкість золів можна шляхом додання до них ВМС, макромолекули яких утворюють захисну структуру на поверхні часточок. Мірою захисної дії ВМС є захисне число, що визначається кількістю сухого полімеру у мг, яка достатня для захисту від коагуляції 10 мл золю. Якщо кількість полімеру, що додають до золю недостатня, то спостерігається зниження стійкості золю під час додання ВМС – сенсибілізація. Це пояснюється тим, що макромолекул ВМС не вистачає для утворення суцільного захисного адсорбційного шару. Найдовші частини ланцюгів ВМС при цьому можуть утворювати так звані «містки», що притягують макромолекули одна до одної і, таким чином, сприяють коагуляції.
Пептизацією називається зворотний перехід у колоїдний розчин осадів, що утворилися під час коагуляції.Для пептизації коагулят промивають водою і додають речовину, яка буде виконувати роль стабілізатору. Перемішування і підвищення температури сприяє пептизації.
Лекція №20
Ліофільні дисперсні системи
План лекції
1. Колоїдні поверхнево-активні речовини. Будова і форма міцел ПАР.
2. Гідрофільно-ліпофільний баланс. Солюбілізація жирів і вітамінів.
3. Емульсії. Класифікація емульсій.. Гомогенізація емульсій.
4. Емульгатори, їх класифікація. Руйнування і обернення фаз емульсій.
Рекомендована література: [1] С.528-532, [3] С.138-145.
20.1 Колоїдні поверхнево-активні речовини
 Молекули ПАР мають дифільну будову і складаються з неполярного гідрофобного вуглеводневого радикалу і полярної гідрофільної функціональної групи. Якщо у радикалах молекул ПАР кількість атомів Карбону перевищує 8 одиниць, то такі речовини відносять до колоїдних ПАР. Від інших ПАР їх відрізняє дуже висока поверхнева активність і здатність утворювати міцели – агрегати із десятків дифільних молекул або іонів ПАР. Першу модель будови кульових міцел ПАР запропонував Гартлі. У полярних розчинниках гідрофільні функціональні групи молекул ПАР розташовані на поверхні міцел, а неполярні ланцюги повернені в їх об’єм. Таким чином, внутрішня частина міцел являє собою «краплину» неполярної рідини. У неполярних розчинниках вуглеводневі радикали молекул ПАР навпаки знаходяться на поверхні міцел, а полярні групи в їх об’ємі. При підвищенні концентрації ПАР у розчині кульові міцели починають взаємодіяти між собою, змінюючи свою форму (див. рис.20.1.).
Молекули ПАР мають дифільну будову і складаються з неполярного гідрофобного вуглеводневого радикалу і полярної гідрофільної функціональної групи. Якщо у радикалах молекул ПАР кількість атомів Карбону перевищує 8 одиниць, то такі речовини відносять до колоїдних ПАР. Від інших ПАР їх відрізняє дуже висока поверхнева активність і здатність утворювати міцели – агрегати із десятків дифільних молекул або іонів ПАР. Першу модель будови кульових міцел ПАР запропонував Гартлі. У полярних розчинниках гідрофільні функціональні групи молекул ПАР розташовані на поверхні міцел, а неполярні ланцюги повернені в їх об’єм. Таким чином, внутрішня частина міцел являє собою «краплину» неполярної рідини. У неполярних розчинниках вуглеводневі радикали молекул ПАР навпаки знаходяться на поверхні міцел, а полярні групи в їх об’ємі. При підвищенні концентрації ПАР у розчині кульові міцели починають взаємодіяти між собою, змінюючи свою форму (див. рис.20.1.).
Рисунок 20.1– Форма міцел ПАР у полярних розчинниках: а – кульова; б – дископодібна; в – циліндрична.
Критична концентрація міцелоутворення (ККМ) – мінімальна концентрація ПАР, за якої у розчинах починають утворюватися міцели. Для більшості колоїдних ПАР значення ККМ становлять 10–5...10–3 моль/л. Властивості розчинів ПАР зазнають різких змін при переході від низьких концентрацій (менших за ККМ) до більш високих. На практиці ККМ визначають за зміною електропровідності, поверхневого натягу, осмотичного тиску, показника заломлення і каламутності розчинів ПАР.
20.2 Гідрофільно-ліпофільний баланс
Властивості колоїдних ПАР визначаються співвідношенням в їх молекулах полярної функціональної групи (гідрофільна частина молекули) і вуглеводневого радикалу (ліпофільна частина молекули). Це співвідношення називають гідрофільно-ліпофільним балансом (ГЛБ). За шкалою, розробленою Гріффіном, ГЛБ колоїдних ПАР змінюється в інтервалі від 1 до 40 умовних чисел. Чим краще ПАР розчиняється у воді, тим вище значення її ГЛБ і, навпаки, чим нижче ГЛБ, тим краще речовина розчиняється у неполярних рідинах. ГЛБ є величиною адитивною: значення ГЛБ молекули ПАР можна розрахувати за такою формулою:
ГЛБПАР = 7 + ГЛБ(полярної групи) – ГЛБ(радикалу).
Кожна функціональна група має певне значення ГЛБ, яке можна узяти у довідниках. За значеннями ГЛБ визначають галузі застосування ПАР. Так, ПАР-змочувачі повинні мати ГЛБ рівним 7...9, емульгатори 3...5 або 8...13 у залежності від типу емульсії, миючі засоби – 13-15, солюбілізатори – 15-18 і т.д.
Солюбілізація – розчинення у водних розчинах ПАР речовин, які у чистій воді не розчиняються, насамперед олій і жирів. Солюбілізація неполярних сполук у розчинах ПАР пояснюється розчиненням їх молекул у вуглеводневій частині міцели. Неполярні рідини розчиняються в ядрах міцел, а полярні органічні речовини розташовуються у міцелах так, щоб їх вуглеводневі ланцюги були напрямлені в об’єм міцели, а полярні групи – у водну фазу.
20.3 Емульсії
Емульсії – дисперсні системи, що складаються із взаємно нерозчинних рідин, одна з яких знаходиться у вигляді краплинок певного розміру.До емульсій відносять такі харчових продукти, як молоко і молочні вироби, бульйони тощо.
Класифікація емульсій. Рідини, що утворюють емульсію повинні розрізнятися за своєю полярністю. У залежності від природи рідин емульсії бувають двох типів:
· емульсія типу М/В (" масло у воді"), в яких дисперсна фаза – неполярна рідина (олії, гас), а дисперсійне середовище – вода або інші полярні рідини.
· емульсія типу В/М (" вода у маслі"), в яких дисперсна фаза – крапельки полярної рідини, що розподілені у неполярному середовищі.
У залежності від вмісту в емульсіях дисперсної фази вони поділяються на розбавленні (w < 1 %), концентровані (1%< w < 74%) і желатиновані (w > 74%), де w – об’ємна частка дисперсної фази в емульсії.
У желатинованих емульсіях має місце взаємна деформація крапель, і вони перетворюються на неправильні багатогранники, оточені тонкими плівками тієї рідини, що виконує роль дисперсійного середовища. Желатиновані емульсії здатні зберігати свою форму. Прикладом такої емульсій є вершкове масло.
Методи визначення типу емульсій. Емульсії В/М і М/В кардинально відрізняються за своїми властивостями, але візуально визначити до якого типу відноситься та чи інша емульсії неможливо. Визначення типу емульсій здійснюється такими методами. Кондуктометричний метод ґрунтується на вимірюванні електропровідності емульсії. Емульсія типу М/В проводить електричний струм, а емульсія В/М – ні. Флуоресцентний метод ґрунтується на визначенні кольору емульсій під час їх опромінювання ультрафіолетовим світлом: емульсія В/М змінює своє забарвлення, емульсія М/В – не флуоресціює. Мікроскопічний метод ґрунтується на різній розчинності барвників у полярних і неполярних розчинниках. При застосуванні цього методу до емульсії додають порошок барвника і у мікроскопі спостерігають розподіл кольору в об’ємі емульсії. Так, якщо при доданні гідрофільного барвника блакитного кольору середовище емульсії стає блакитним – це емульсія М/В.
Більшість природних емульсій полідисперсні і містять різні за розмірами часточки дисперсної фази. Такі емульсії часто розшаровуються під час зберігання. Зменшення і вирівнювання розмірів крапель емульсії називаютьгомогенізацією. Гомогенізацію проводять шляхом продавлення емульсії через мембрани з малими отворами під значним тиском, або застосовуючи ультразвуковий струминний генератор. Гомогенізація підвищує стабільність емульсій.
|
|