
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Головні поняття та визначення
|
|
Міністерство освіти і науки України
Полтавський національний технічний університет
Імені Юрія Кондратюка
Кафедра теплогазопостачання, вентиляції та теплоенергетики
КУРС ЛЕКЦІЙ
з дисципліни
«ТЕОРЕТИЧНІ ОСНОВИ ТЕПЛОТЕХНІКИ»
| Найменування галузі знань | Напрям підготовки | Освітньо-кваліфікаційний рівень |
| 0701 – Транспорт і транспортна інфраструктура | 6.070106 Автомобільний транспорт | бакалавр |
| 0505 – Машинобудування та матеріалообробка | 6.050502 Інженерна механіка | |
| 6.050503 Машинобудування |
ПолтНТУ 2008
Конспект лекцій із дисципліни «Теоретичні основи теплотехніки» для студентів спеціальностей 6.070106 «Автомобільний транспорт», 6.050502 «Інженерна механіка», 6. 050503 «Машинобудування» усіх форм навчання/ Полтава: Полтавський національний технічний університет імені Юрія Кондратюка, 2008, - 58 с.
Укладач: О.Б. Борщ, канд. техн. наук, доцент каф. ТГВ
Відповідальний за випуск: завдувач кафедри теплогазопостачання і вентиляції А.Ф.Строй, доктор техн. наук, професор
Рецензент: Б.А. Кутний, канд. техн. наук. доцент кафедри теплогазопостачання і вентиляції
Затверджено радою університету
протокол № від.. 2008 р.
Редактор Н.В.Жигилій
Коректор Н.О.Янкевич
Зміст
1. Головні поняття та визначення........ 4
2. Параметри стану ідеального газу 7
3. Процеси зміни параметрів ідеального газу.. 13
4. Реальні гази та суміші газів 18
5. Перший та другий закони термодинаміки...... 20
6. I-d діаграма вологого повітря.... 24
7. Водяна пара. Процеси водяної пари..... 28
8. Стискування газів у компресорах, Процеси дроселювання та витікання. 34
9. Цикли теплових двигунів....... 43
10. Цикли холодильних машин........ 47
11. Цикли паросилових установок....... 54
Перелік літературних джерел....... 53
Лекція №1. Головні поняття та визначення
Вступ
Головними забруднювачами оточуючого середовища є техногенне забруднення (побутові відходи, відходи промислових підприємств, транспорту та результати військових розробок). Відомо, що в Україні щорічно викидається 6.5 млн тон шкідливих речовин (промисловість + транспорт). В Києві 80% забруднень створює транспорт. Крім того, значний вплив на екосистему мають різноманітні природні фактори такі як: повені, виверження вулканів, цунамі, пожежі та техногенні катастрофи.
Цей комплекс дисциплін є основою для розрахунку більшості природних та технологічних процесів. Їх знання дозволяє прогнозувати перебіг природних та технологічних процесів, підвищувати ККД двигунів чи змінювати технологічний процес на більш раціональний, зменшуючи при цьому кількість шкідливих викидів. Крім того, ці дисципліни є основою для розрахунку очисних та відновлюваних процесів які застосовуються в апаратах для очищення повітря та води.
Головні поняття та визначення
Термодинаміка – це наука, що вивчає закони перетворення енергії в різноманітних процесах, які супроводжуються поглинанням або виділенням тепла.
Види термодинаміки: загальна, технічна і хімічна.
Загальна термодинаміка – розглядає теоретичні основи і їх застосування для дослідження фізичних явищ (електроенергія, магнетизм, випромінення та ін.) і властивостей різноманітних тіл.
Технічна термодинаміка – вивчає теплові процеси в теплових двигунах і обладнанні. Її головним завданням є пошук найбільш раціональних способів перетворення теплоти в роботу і навпаки.
Хімічна термодинаміка – вивчає хімічні та фізико-хімічні процеси перетворення енергії.
Термодинамічна система – система тіл, що обмінюються енергією між собою та з навколишнім середовищем. Якщо система не взаємодіє з оточуючим середовищем, вона називається ізольованою. Система називається закритою якщо її маса залишається незмінною. Системи зі змінною масою називаються відкритими.
Фізичні величини, що характеризують стан термодинамічної системи називають термодинамічними параметрами. У якості параметрів стану в термодинаміці використовують: питомий об’єм, тиск, температуру, концентрацію та інші величини. Параметри стану системи поділяють на зовнішні та внутрішні.
Зовнішніми параметрами системи називають величини, що залежать лише від положення зовнішніх тіл і їх характеристик. Наприклад об’єм посуду в якому знаходиться газ, електричне або інші силові поля.
Внутрішні параметри системи залежать не лише від положення зовнішніх тіл, але і від характеристик частинок, що утворюють цю систему. Наприклад тиск і температура газу.
Тиск – величина сили, що діє на одиницю площі поверхні тіла перпендикулярно до неї. В техніці застосовують: абсолютний тик, надлишковий тиск та розрідження. Одиницями вимірювання тиску є: Па, м.в.ст, мм. рт. ст., атмосфера. 101325 Па = 760 мм.рт.ст. = 1 атм.
Абсолютний тиск РА визначається як сума барометричного (атмосферного) РБАР і надлишкового (манометричного) РМАН тиску
РА= РБАР + РМАН, Па, кПа, МПа.
У таблиці 1 наведені співвідношення між різними одиницями вимірювання тиску.
Таблиця 1
| № з/п | Одиниці вимірювання | Па | кгс/см2, (ат) | кгс/м2, (мм вод. ст.) | мм рт. ст. | бар |
| 1 Па | 1, 02·10–5 | 0, 102 | 7, 5·10–3 | 10–5 | ||
| 1кгс/см2 =1ат | 9, 8·104 | 0, 98 | ||||
| 1мм вод. ст. = 1 кгс/м2 | 9, 8 | 10–4 | 7, 35·10–2 | 9, 8·10–5 | ||
| 1мм рт. ст. | 1, 3·10–3 | 13, 6 | 1, 3·10–3 | |||
| 1бар | 105 | 1, 02 | 7, 5·102 |
Температура – параметр, що характеризує тепловий стан тіла. Вона є мірою хаотичного руху молекул. Прийнятими одиницями вимірювання є ОС і К.
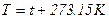
Існують такі шкали вимірювання температур:
–шкала Цельсія t 0С; за 0 0С у якій прийнято вважати температуру переходу води в кристалічний стан за нормальних умов (НУ), а за 100 0С – стан кипіння тієї ж самої води за НУ;
– шкала Кельвіна T 0K, у якій за 0 0K прийнятий стан, що називають абсолютним нулем, – температура, при котрій у будь-якому тілі припиняється рух молекул. T (0K)= 273, 15+ t (0С);
– 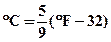 шкала Фаренгейта 0F. У цій шкалі температури плавлення льоду і кипіння води прийняті відповідно за 320 і 2120, .
шкала Фаренгейта 0F. У цій шкалі температури плавлення льоду і кипіння води прийняті відповідно за 320 і 2120, .
У термодинаміці температуру виражають, як правило, за шкалою Кель-віна (абсолютна температура), º К.
Густину різних газів робочих тіл за нормальних умов, тобто при температурі Оº С і тиску 0, 1 МПа, можна визначити за їх молярним об’ємом, що дорівнює 22, 4 нм3 та масі одного кіломоля μ, кг,
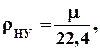 кг/нм3.
кг/нм3.
При збільшенні тиску і зменшенні температури газів їх густина зростає. При температурі t, º С, і надлишковому тиску Р, МПа, густина газу визначається за формулою
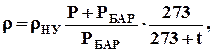 кг/м3,
кг/м3,
де РБАР – барометричний тиск за нормальних умов, РБАР =0, 1МПа.
Питомим об’ємом υ є величина, обернена густині робочого тіла ρ, кг/м3,
υ = 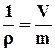 , м3/кг,
, м3/кг,
деV, m – об’єм та маса робочого тіла відповідно при заданих значеннях тиску РА і температури Т.
Стан термодинамічної рівноваги (стаціонарний стан) – такій стан системи який не змінюється з плином часу.
При зміні зовнішніх параметрів системи буде змінюватися і стан системи – система буде здійснювати термодинамічний процес.
Термодинамічний процес називають рівноважним якщо в ньому система проходить через неперервну послідовність безкінечно близьких станів її термодинамічної рівноваги. Такий процес здійснюється при малих різницях температур оточуючого середовища і термодинамічної системи.
Нерівноважний стан це стан переходу термодинамічної системи з одного рівноважного стану в інший за кінцевий проміжок часу. Такі процеси відбуваються при великих різницях температур та супроводжуються нерівномірним розподілом тиску по усій термодинамічній системі.
Рівноважний термодинамічний процес називають прямим якщо він пов’язаний з розширенням робочого тіла. Якщо він пов’язаний зі стисканням робочого тіла – зворотним процесом.
Процеси, що можуть протікати у прямому і зворотному напрямку називають оборотними. Для того, щоб процес був оборотний необхідно: відсутність хімічних реакцій в робочому тілі, відсутність тертя, безкінечний проміжок часу проміжок часу протікання процесу. До оборотних процесів можна віднести процеси що здійснюються з паром в парових електростанціях.
Якщо в результаті здійснення прямого і зворотного процесів робоче тіло не повертається у вихідне положення то такий процес називається необоротним. Прикладами таких процесів є: згорання палива, передача теплоти від гарячого тіла до холодного.
Якщо при постійній масі газу значення всіх його параметрів на початку і в кінці процесу однакові, то такий процес називають круговим або замкненим.
У взаємоперетвореннях теплової та механічної енергії приймає участь робоче тіло. У якості робочого тіла можуть застосовуватися: тверді тіла, рідини і гази. Однак в технічній термодинаміці у якості робочого тіла найбільш часто застосовують саме гази. Це пов’язано з тим. що газ має великий коефіцієнт об’ємного розширення, що дозволяє ефективно застосовувати його в процесах взаємного перетворення теплоти в роботу і навпаки.
В термодинаміці застосовують два поняття газів: реальні та ідеальні.
Реальний газ – газ, молекули якого мають сили взаємодії і кінцеві (хоч і досить малі) розміри. В реальних газах існують сили міжмолекулярного протягування і відштовхування.
Ідеальний газ – газ, молекули якого мають безкінечно малий власний об’єм і не взаємодіють одна з іншою на відстані. Ідеальний газ це найпростіша модель робочого тіла.
Для графічного відображення термодинамічних процесів застосовують термодинамічні діаграми. Найпростішою є діаграма P-V. Крім неї також застосовують діаграми в координатах T-S, i-S, i-d.
Моль – кількість речовини, маса якої в грамах рівна її відносній молекулярній масі (водень – 2 гр, азот – 28 гр.).
Нормальні умови – термодинамічна система при температурі 273 К і тиску 101325 Па.
|
|