
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Нарушения реологических свойств крови, вызывающие стаз в микрососудах
|
|
Реологические свойства крови как неоднородной жидкости имеют особо важное значение при ее течении по микрососудам, просвет которых сопоставим с величиной ее форменных элементов. При движении в просвете капилляров и прилегающих к ним мельчайших артерий и вен эритроциты и лейкоциты меняют свою форму -изгибаются, вытягиваются в длину и т. д. Нормальное течение крови по микрососудам возможно только при условиях, если: а) форменные элементы могут легко деформироваться; б) они не склеиваются между собой и не образуют агрегаты, которые могли бы затруднять кровоток и даже полностью закупоривать просвет микрососудов, и в) концентрация форменных элементов крови не является избыточной. Все эти свойства важны прежде всего у эритроцитов, так как число их в крови человека примерно в тысячу раз превышает количество лейкоцитов.
Наиболее доступным и широко используемым в клинике способом определения реологических свойств крови у больных является ее вискозиметрия. Однако условия движения крови в любых известных в настоящее время вискозиметрах значительно отличаются от тех, которые имеют место в живом микроциркуляторном русле. Ввиду этого данные, получаемые при вискозиметрии, отражают лишь некоторые общие реологические свойства крови, которые могут способствовать либо препятствовать ее тече-
Глава 8 / ПАТОФИЗИОЛОГИЯ ПЕРИФЕРИЧЕСКОГО (ОРГАННОГО) КРОВООБРАЩЕНИЯ
нию по микрососудам в организме. Ту вязкость крови, которую выявляют в вискозиметрах, называют относительной вязкостью, сравнивая ее с вязкостью воды, которую принимают за единицу.
Нарушения реологических свойств крови в микрососудах связаны главным образом с изменениями свойств эритроцитов в протекающей по ним крови. Такие изменения крови могут возникать не только по всей сосудистой системе организма, но и местно в каких-либо органах или их частях, как, например, это всегда имеет место в очагах воспаления. Ниже перечислены основные факторы, определяющие нарушения реологических свойств крови в микрососудах организма.
8.4.1. Нарушение деформируемости эритроцитов
Эритроциты изменяют свою форму при течении крови не только по капиллярам, но и в более широких артериях и венах, где они бывают обычно вытянутыми в длину. Способность деформироваться (деформируемость) у эритроцитов связана главным образом со свойствами их наружной мембраны, а также с высокой текучестью их содержимого. В потоке крови происходят вращательные движения мембраны вокруг содержимого эритроцитов, которое также перемещается.
Деформируемость эритроцитов чрезвычайно изменчива при естественных условиях. Она постепенно уменьшается с возрастом эритроцитов, в результате чего создается препятствие для их прохождения по наиболее узким (диаметром 3 мкм) капиллярам ретикулоэндотелиальной системы. Предполагается, что благодаря этому происходит «распознавание» старых эритроцитов и их устранение из кровеносной системы.
Мембраны эритроцитов становятся более жесткими под влиянием различных патогенных факторов, например потери ими АТФ, гиперос-молярности и т. д. В результате реологические свойства крови изменяются таким образом, что ее течение по микрососудам затрудняется. Это имеет место при заболеваниях сердца, несахарном диабете, раке, стрессах и т. д., при которых текучесть крови в микрососудах оказывается значительно пониженной.
8.4.2. Нарушение структуры потока
крови в микрососудах
В просвете сосудов поток крови характеризуется сложной структурой, связанной: а) с неравномерным распределением неагрегирован-ных эритроцитов в потоке крови по поперечнику сосуда; б) со своеобразной ориентацией эритроцитов в потоке, которая может меняться от продольной до поперечной; в) с траекторией движения эритроцитов внутри сосудистого просвета; г) с профилем скоростей отдельных слоев крови, который может изменяться от параболического до затупленного разной степени. Все это может оказывать значительное влияние на текучесть крови в сосудах.
С точки зрения нарушений реологических свойств крови особое значение имеют изменения структуры потока крови в микрососудах диаметром 15-80 мкм, т. е. несколько более широких, чем капилляры. Так, при первичном замедлении кровотока продольная ориентация эритроцитов часто сменяется на поперечную, профиль скоростей в сосудистом просвете затупляется, траектория движения эритроцитов становится хаотичной. Все это приводит к таким изменениям реологических свойств крови, когда сопротивление кровотоку значительно увеличивается, вызывая еще большее замедление течения крови в капиллярах и нарушая микроциркуляцию.
8.4.3. Усиленная внутрисосудистая
агрегация эритроцитов,
вызывающая стаз крови
в микрососудах
Способность эритроцитов к агрегации, т. е. к слипанию и образованию «монетных столбиков», которые затем склеиваются между собой, является их нормальным свойством. Однако агрегация может значительно усиливаться под влиянием разных факторов, изменяющих как поверхностные свойства эритроцитов, так и среду, окружающую их. При усилении агрегации кровь превращается из взвеси эритроцитов с высокой текучестью в сетчатую суспензию, полностью лишенную этой способности. В общем агрегация эритроцитов нарушает нормальную структуру кровотока в микрососудах и является, должно быть, наиболее важным фактором, изменяющим нормальные реологические свойства крови.
Часть II. ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ
При прямых наблюдениях кровотока в мик-эсудах иногда можно видеть внутрисосудис-гую агрегацию эритроцитов, названную «зернистых током крови». При усилении внутрисосу-гой агрегации эритроцитов во всей кровенос-_ теме агрегаты могут закупоривать мель-пшие прекапиллярные артериолы, вызывая крушения кровотока в соответствующих капил-
- =рах. Усиленная агрегация эритроцитов может
■ шн икать также местно, в микрососудах, и на-
:;.—ать микрореологические свойства текущей
: них кропи до такой степени, что кровоток в
капиллярах замедляется и останавливается пол-
=: стью - возникает стаз, несмотря на то, что ар-
■ цяювенозная разность кровяного давления на
протяжении этих микрососудов сохранена. При
гпш в капиллярах, мелких артериях и венах ■ ■ шипит ми и ii эритроциты, которые тесно соприкасаются друг с другом, так что границы их ■ ерестают быть видимыми («гомогенизация крови»)- Однако вначале при стазе крови ни гемолиза, ни свертывания крови не происходит. В течение некоторого времени стаз обратим - дви-жение эритроцитов может возобновляться и про-аэдимость микрососудов опять восстанавливает-
- Я.
На возникновение внутрикапиллярной агрегации эритроцитов оказывает влияние ряд факторов:
1. Повреждение стенок капилляров, вызывающее усиление фильтрации жидкости, электролитов и низкомолекулярных белков (альбуминов) в окружающие ткани. Вследствие этого в плазме крови увеличивается концентрация высокомолекулярных белков - глобулинов и фибриногена, что, в свою очередь, является важ-
нейшим фактором усиления агрегации эритроцитов. Предполагается, что абсорбция этих белков на мембранах эритроцитов уменьшает их поверхностный потенциал и способствует их агрегации. 2. Проникновение химических повреждающих агентов внутрь капилляров и непосредственное действие их на эритроциты, вызывающее изменение физико-химических свойств их мембран и способствующее их агрегации.
3. Скорость кровотока в капиллярах, обусловленная функциональным состоянием приводящих артерий. Констрикция этих артерий вызывает замедление кровотока в капиллярах (ише-
Глава 8 / ПАТОФИЗИОЛОГИЯ ПЕРИФЕРИЧЕСКОГО
13 Чакда № 532
мию), способствуя агрегации эритроцитов и развитию стаза в капиллярах. При дилятации приводящих артерий и ускорении кровотока в капиллярах (артериальная гиперемия) внутрика-пиллярная агрегация эритроцитов и стаз развиваются труднее и устраняются значительно легче.
8.4.4. Изменение концентрации
эритроцитов в циркулирующей
крови
Содержание эритроцитов в крови считается важным фактором, влияющим на ее реологические свойства, так как при вискозиметрии обнаруживается прямая зависимость между концентрацией эритроцитов в крови и ее относительной вязкостью. Объемная концентрация эритроцитов в крови (гематокрит) может меняться в значительной степени как во всей кровеносной системе, так и местно. В микроциркуляторном русле тех или иных органов и их отдельных частей содержание эритроцитов зависит от интенсивности кровотока. Однако насколько это изменяет реологические свойства крови в соответствующих микрососудах - пока точно не установлено. Несомненно лишь то, что при значительном увеличении концентрации эритроцитов в кровеносной системе реологические свойства крови могут заметно меняться.
8.4.5. Последствия стаза крови
в микрососудах
Если в период стаза значительных изменений в стенках микрососудов и в находящейся в них крови (вследствие нарушения ее нормальных реологических свойств) не произошло, кровоток может восстановиться после устранения причин стаза. Однако при больших повреждениях сосудистых стенок и эритроцитов стаз крови может оказаться необратимым, вызывая некроз окружающих тканей. Этому во многом способствуют спазм или закупорка приводящих артерий и нарушение кровоснабжения данного участка ткани, т.е. ее ишемия. Патогенное значение стаза крови в капиллярах в значительной степени зависит от того, в каком органе он возник. Так, особенно опасен стаз крови в микрососудах головного мозга, сердца и почек. Стойкий стаз в капиллярах приводит в конце
(ОРГАННОГО) КРОВООБРАЩЕНИЯ 193
концов к некрозу (инфаркту) окружающих тканей.
8.5. ТРОМБОЗ
Тромбоз - прижизненное отложение сгустка стабилизированного фибрина и форменных элементов крови на внутренней поверхности кровеносных сосудов с частичной или полной обтурацией их просвета.
В отличие от внутрисосудистого свертывания крови, связанного с появлением в кровеносном русле рыхлых, слабо фиксированных на стенках сосудов фибриновых сгустков, в ходе тром-ботического процесса формируются плотные депозиты крови, которые прочно «прирастают» к субэндотелиальным структурам и реже эмболи-зируют в другие сосудистые регионы. В среднем период полной трансформации кровяного сгустка в тромб завершается не ранее чем через 6 ч от начала внутрисосудистого свертывания крови.
Структура формирующихся тромбов зависит от особенностей кровотока в сосуде. В артериальной системе, характеризующейся высокой скоростью кровотока, тромбы состоят в основном из тромбоцитов («белая головка») с небольшой примесью эритроцитов и лейкоцитов («красный хвост»), оседающих в сетях стабилизированного фибрина, тогда как в венозной системе, отличающейся значительно более низкой скоростью кровотока, - из эритроцитов, лейкоцитов и небольшого количества тромбоцитов, придающих тромбу гомогенно-красный цвет. Содержание тромбоцитов в артериальных тромбах существенно выше, чем в венозных, а в обоих видах тромбов гораздо выше, чем в крови. Количество эритроцитов в артериальных тромбах несколько ниже, а в венозных почти эквивалентно содержанию их в крови. Уровень фибриногена в обоих видах тромбов соответствует приблизительно двукратной концентрации фибриногена плазмы крови.
Частота возникновения тромбоза исключительно велика. Помимо самостоятельного ге-неза он может встречаться при самых различных заболеваниях сердечно-сосудистой, дыхательной, кроветворной, пищеварительной и мочеполовой систем, при нарушениях нервной, гормональной и иммунной регуляции, воспалении, шоке, в различные периоды операционной
травмы, в до- и послеродовом периоде, при действии на организм бактериальных и химических токсинов, ядов, ионизирующего излучения, гравитационных факторов, барометрического давления, нарушениях биоритма и многих других неблагоприятных воздействиях.
8.5.1. Механизмы тромбообразования в артериях
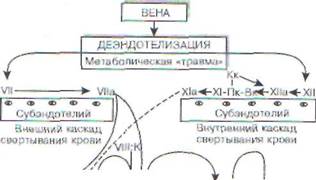
Ключевыми механизмами тромбообразования в артериях являются: 1) повреждение сосудистого эндотелия; 2) локальный ангиоспазм; 3) адгезия тромбоцитов к участку обнаженного субэндотелия; 4) агрегация тромбоцитов как на поверхности адгезировавших клеток, так и в отдалении от них; 5) активация свертывающей способности крови при снижении ее фибриноли-тических свойств.
Повреждение эндотелия может носить как травматический, так и метаболический характер. В первом случае происходит обнажение тромбогенных компонентов базальной мембраны - коллагена, эластина и микрофибрилл с последующей адгезией к ним тромбоцитов и образованием первичного гемостатического «гвоздя». Во втором случае эндотелий сохраняет морфологическую целостность, однако в функциональном отношении он не может обеспечить полноценную кровесовместимость к тромбоцитам и другим форменным элементам крови за счет потери способности:
1) синтезировать антитромботические, проти-восвертывающие и фибринолитические вещества (активатор плазминогена, простациклин, фактор релаксации - N0, гепариноподобные протеогли-каны гепаран- и дерматансульфат);
2) инактивировать прокоагулянтные вещества (V, VIII, IX и X коагуляционные факторы, тромбин, тромбопластин);
3) метаболизировать биологически активные вещества - гормоны, медиаторы белковой и ли-пидной природы, которые прямо или косвенно влияют на систему гемостаза и стенку кровеносных сосудов (биогенные амины, простагланди-ны, тромбоксан А, лейкотриены, тромбоцитак-тивирующий фактор - ТАФ, адениловые нукле-отиды, атерогенные липопротеиды, вазоактивные пептиды, плазменные кинины).
Нарушение метаболической функции эндоте-лиальных клеток приводит к развитию внутри-
Часть II. ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ
: судистого свертывания крови независимо от s структурных перестроек, которые могут заекать тромботический процесс. При травматическом повреждении сосуда эомбоз начинается с адгезии тромбоцитов к |стку деэндотелизации. Последняя включает рв этапа: 1) активацию тромбоцитарной мемб- члы; 2) фиксацию активированных тромбоци-вш к галактозиловым группам молекулы кол-ьгена; 3) сокращение тромбоцитов с появлениях псевдоподии.
Активация тромбоцитов является сложным таболическим процессом, связанным с хими-кой модификацией тромбоцитарных мембран аддукцией в них фермента гликозилтрансфе-оы, который взаимодействует со специфически рецептором на молекуле коллагена и обес- чивает тем самым «посадку» тромбоцита на Иввдотелий. Наряду с гликозилтрансферазой активи-тся и другие мембраносвязанные ферменты, астности фосфолипаза А2, обладающая наи-лыпей аффинностью по отношению к фосфа-виэтаноламину. Гидролиз последнего запус-I каскад реакций, включающих высвобож-яе арахидоновой кислоты и последующее об-жание из нее под действием фермента цик-еназы короткоживущих циклических Ююерекисей PGN2 и PGG,,, трансформирую-и под влиянием фермента тромбоксансин-вы в один из самых мощных индукторов аг-ши тромбоцитов и вазоконстрикторов - тром-Ъкгая А,.
Активированный тромбоцит представляет со-своеобразную «пулю», нацеленную на деэн-вввированный участок. Достигнув этого уча-тотчас распластывается на коллагене и екает псевдоподии. Однако для успешной ковки» тромбоцита с коллагеном необходи-сзательное присутствие фактора Виллебран-\зменного фибронектина. В отсутствие белков адгезия не происходит.)ормация тромбоцитов, посаженных на ген, и изменение их формы являются тиле сократительным процессом. В нем при-г участие весь тот набор сократительных ав актомиозинового комплекса, который > ует сокращение гладкомышечных кле-
тевая роль в сократительном акте уделя- i транспорту Са2+ из плотной тубулярной
[ПАТОФИЗИОЛОГИЯ ПЕРИФЕРИЧЕСКОГО
системы, являющейся эквивалентом саркоплаз-матического ретикулума мышц, в цитоплазму. Другие кальциевые пулы, а их в тромбоцитах четыре (плотная тубулярная система, цитоплазма, плотные тельца и митохондрии), не принимают участия в этом процессе. Регуляция транспорта Са2+ осуществляется Са2+-связывающими белками, из которых наиболее значительную роль играет кальмодулин.
Для выполнения транспортной функции Са2+-связывающие белки должны находиться в фос-форилированном состоянии. Фосфорилирование внутриклеточных белков регулируется протеин-киназами циклического 3', 5'-аденозинмонофос-фата (цАМФ). Следовательно, транспорт Са2+ и сокращение тромбоцитов тесным образом связаны с внутриклеточным содержанием цАМФ. Снижение в тромбоцитах уровня цАМФ является одним из ранних критериев нарушения функционального состояния тромбоцитов.
Неблагоприятные последствия аккумуляции внутриклеточного Са2+ в сократившихся тромбоцитах связаны по меньшей мере с четырьмя эффектами: 1) разрывом микротрубочек, выполняющих в тромбоците функцию цитоскелета; 2) активацией гуанилатциклазы и усилением синтеза циклического 3', 5'ГМФ, обладающего про-агрегирующим действием; 3) повышением активности фосфолипазы А2 с последующей генерацией тромбоксана А2 и 4) индукцией фосфолипазы С, «нарабатывающей» продукты фосфо-инозитидного обмена (1, 2-диацилглицерол, фос-фатидная и лизофосфатидная кислоты), повышающие агрегационную способность тромбоцитов как зависимым, так и независимым от тромбоксана А,, путем.
Адгезия тромбоцитов к субэндотелию является, по существу, I стадией на пути формирования артериального тромбоза. Вслед за ней наступает II стадия агрегации тромбоцитов, состоящая, в свою очередь, из двух последовательных фаз. Первая фаза характеризуется деграну-ляцией и выбросом из тромбоцитов содержимого плотных телец (АДФ, АТФ, АМФ, Фн, адреналина, норадреналина, серотонина, гистамина, ионов Са2+ и др.), вторая - содержимого а-гра-нул (лизосомальные ферменты и др.). При этом мембраны депонирующих гранул сливаются с плазматической мембраной и мембраной каналь-цевой системы тромбоцитов, связанных с поверхностью, в результате чего образуется брешь, че-
(ОРГАННОГО) КРОВООБРАЩЕНИЯ
рез которую содержимое органелл выбрасывается наружу.
Появление в кровотоке компонентов тромбо-цитарных гранул приводит к активации соседних интактных тромбоцитов, приклеиванию их друг к другу и к поверхности адгезированных клеток, а в конечном счете - к формированию крупных агрегатов, составляющих основу тром-боцитарного тромба. Одновременно возникает спазм сосуда, вызванный локальным выделением тромбоксана А2 и других вазоактивных веществ.
На практике наибольшее диагностическое значение для выявления повышенной агрегации придается высвобождению в кровоток компонентов плотных телец: АДФ, серотонина, Р-тром-боглобулина и 4-го фактора.
Важную роль играет и уровень 3-го тромбо-цитарного фактора, отражающего изменения
топографии мембранных фосфолипидов, экспозицию на поверхности тех из них, которые в норме находятся в «глубине» плазматической мембраны. К ним, в частности, относится фос-фатидилсерин, мигрирующий на наружную поверхность мембраны тромбоцитов взамен сфин-гомиелина по типу «флип-флоп».
Агрегация тромбоцитов не развивается в отсутствие внеклеточного Са2+, фибриногена и белка, природа которого пока не выяснена. Последний, в частности, отсутствует в плазме крови больных тромбастенией Гланцмана.
Заключительная стадия тромбогенеза связана с активацией контактных факторов плазменного гемостаза, которые адсорбируются на поверхности агрегированных тромбоцитов и запускают «внутренний каскад» свертывания крови, завершающийся выпадением нитей стабилизированного фибрина и консолидацией тромба.
гаку также способствует снижение фибрино-гтнческой активации крови, ответственной за.жзис фибриновых сгустков.
Наряду с «внутренним каскадом» в процесс 1ромбообразования включается и «внешний каскад» свертывания крови, связанный с высвобож-евием тканевого тромбопластина.
Активация плазменного гемостаза может воз-жкать и при отсутствии контактных факторов. > этом случае тромбоциты сами запускают «внут-еиний каскад» путем взаимодействия экспони-«■ анного на их поверхности V фактора с Характером плазмы, который быстро катализиру-: древращение протромбина в тромбин. Таким образом, тромбоциты выполняют уни-Еюьную роль поверхности, связывающей два хновных звена процесса внутрисосудистого тромбообразования - агрегацию и выпадение сгустка фибрина.
Важно учитывать, что образование полимеров горина в артериальной циркуляции всегда ог-ьннчено и происходит дистальнее тромбоцитар-н «головки» тромба. Это объясняется высокой яростью кровотока, облегчающей разведение ■ даление активированных белков свертывания, вторые обеспечивают достаточную доставку гнбиторов свертывания - антитромбина III, фактора гепарина II, протеинов Сив. Помимо тромбоцитов в образовании внутри-■ даистых тромбов принимают участие и дру-тки крови, в частности эритроциты и социты. Способность указанных клеток к оукции тромботического процесса связана не -гъко с пассивным захватом их фибриновой яыо, но и активным воздействием на гемоста-й процесс. Последнее особенно наглядно яется при гемолизе эритроцитов, фовождающемся обильным «наводнением» шаатмы АДФ и развитием необратимой агрегату тромбоцитов.
1ередко причиной развития артериального
5оза являются эритроцитоз, приводящий к
жашчению вязкости крови и застою ее в систе-
«шкроциркуляции, сфероцитоз и серповид-
очная анемия, при которой закупорка
ких сосудов может произойти вследствие
гаи эритроцитами эластичности и деформи-
хгги, необходимых для преодоления сопро-
; ения в системе мелких сосудов. Имеются
ьзательства того, что эритроциты в силу круп-
азмеров оттесняют циркулирующие рядом
с ними в потоке крови тромбоциты к периферии и облегчают адгезию последних к субэндотелию.
Роль лейкоцитов в механизмах тромбообра-зования изучена менее подробно, однако известно, что в лейкоцитах активно синтезируются продукты липоксигенного пути метаболизма ара-хидоновой кислоты, и в частности, лейкотрие-ны, которые способны оказывать существенное влияние на активность тромбоцитарной тромбок-сансинтетазы с образованием тромбоксана А2. К тому же в нейтрофилах и других клетках грану-лоцитарного ряда синтезируется тромбоцитакти-вирующий фактор, который тоже может стимулировать повышенную агрегацию тромбоцитов и развитие артериального тромбоза.
Из других внутриклеточных компонентов лейкоцитов, высвобождение которых при острых или хронических воспалительных процессах, а также сепсисе, способно активировать циркулирующие в крови интактные тромбоциты и запускать внутрисосудистую агрегацию, наибольшее значение имеют супероксидные и гидро-ксильные анионрадикалы, лизосомальные гидролазы, ферменты, расщепляющие гепарин, про-теиназы типа нейтрофилина и др.
К тромбогенным компонентам лимфоцитов относятся лимфокины, высвобождающиеся, к примеру, из Т-эффекторов при реакциях замедленного типа.
Принципиальная схема механизма тромбооб-разования в артериях представлена на рис. 46.
8.5.2. Механизмы тромбообразования в венах
Венозные тромбозы возникают в результате активации плазменного звена гемостаза, что существенно отличает их от артериальных тромбозов, развивающихся на почве сосудисто-тром-боцитарных конфликтов.
Активации плазменного гемостаза в венах благоприятствует гемодинамическая ситуация, создающаяся вблизи венозных клапанов и в местах бифуркаций с замедленным турбулентным потоком крови. Именно в этих «критических» областях возникают ситуации, способствующие адсорбции контактных факторов (XII фактор Хагемана, высокомолекулярный кининоген, пре-калликреин и XI фактор) на отрицательно заряженных структурах обнаженного субэндотелия и запуску внутреннего каскада свертывания
/ ПАТОФИЗИОЛОГИЯ ПЕРИФЕРИЧЕСКОГО (ОРГАННОГО) КРОВООБРАЩЕНИЯ
крови. При этом активированный XII фактор расщепляет расположенный рядом прекаллик-реин, связанный с кининогеном, превращая его в калликреин, и активирует фактор XI. Последний, в свою очередь, активирует IX фактор, который взаимодействует с активированным фактором Vlllca. Образующийся комплекс VHIca-IXa расщепляет и активирует ближайшие молекулы фактора X, связанного с фосфолипидами тромбоцитов через остатки у-карбоксиглютама-та. В дальнейшем фактор Ха фиксируется на поверхности тромбоцита и присоединяет молекулы активированного фактора V (Va). Молекулы фактора V либо адсорбируются тромбоцитами из плазмы и затем активируются тромбоци-тарными протеазами, либо высвобождаются в активированной форме из сс-гранул.
На поверхности тромбоцитов комплексы Ха-Va соседствуют с молекулами протромбина (фак-

|
| Фибрин- Фибри-мономер ноген |
| Фибрин-полимер |
 Мамбраносвязанные реакции
Мамбраносвязанные реакции
XIII Са,
1< ---------- "
Рис. 47. Патогенез венозного тромб 198
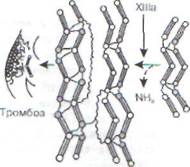
тор II). Под влиянием фактора Ха протромбин внутри этого комплекса расщепляется на две части. Первая содержит все остатки у-карбок-сиглютамата и может в течение некоторого времени оставаться в связанном с тромбоцитами состоянии. Вторая часть поступает в кровоток (тромбин, Па). На заключительном этапе тромбин отщепляет 2 пептида от молекулы фибриногена и превращает его сначала в мономерную форму фибрина, а затем - в полимерную. Образуется типичный венозный тромб, стабилизированный нитями полимеризованного фибрина.
Тромбин и полимеры фибрина могут генерироваться также и внешним путем, который инициируется поступающими в кровоток фосфо-липопротеидными мембранами разрушенных клеток и тканей. Последние связывают через Са2+-мостики у-карбоксиглютаматиые остатки витамин К-зависимого профермента фактора VII и превращают его в активный фактор Vila. Одновременно на поверхности мембран эндотелио-цитов активируются факторы X, V и II со всеми вытекающими последствиями.
Процесс формирования тромбиновых масс в венозной системе лимитируется системой ингибиторов свертывания крови. К ним помимо плаз-мина можно отнести антитромбин III - белок, связывающий факторы ХНа, Х1а, Ха, 1Ха и Па, кофактор II гепарина (специфический белковый ингибитор тромбина), протеины С и S.
В норме молекулы антитромбина III присутствуют в циркулирующей крови и связываются с поверхностью эндотелиальных клеток через гепаран-сульфатированный мукополисахарид. Последний участвует также в инактивации тромбина кофактором II гепарина.
Протеины С и S являются витамин К-зависи-мыми белками, циркулирующими в крови и связывающимися через остатки у-карбоксиглютама-та и Са2+ с мембранами эндотелиоцитов и тромбоцитов (протеин S). Физиологическая роль этих белков заключается в том, что они участвуют в инактивации Villa и Va. Механизм инактивации включает связывание тромбина специфическим рецептором тромбомодулином, локализованным на мембране эндотелиоцитов, и активацию комплексом тромбин-тромбомодулин циркулирующего в крови протеина С. Далее активная молекула протеина С соединяется в крови с молекулой протеина S и образуется комплекс, вызывающий протеолиз и элиминацию активирован-
Часть II. ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ
£ кофакторов свертывания, не обладающих Чвгентативной активностью (Villa и Va).
Активированный протеин С способен уси- жвать локальную фибринолитическую ак-сзность. Этот эффект может иметь место из-за к*ального разрушения протеином С ингибито-астиватора плазминогена, который высвобож- гся из лизосом поврежденных эндотелиоци-■ ■ других тканевых структур. В целом соче- шие действия антитромбина III и системы протеинов С и S в норме предотвращает распространение свертывания на неповрежденную часть сосуда. При развитии венозного тромбоза этот механизм не «срабатывает».
Принципиальная схема механизма тромбооб-разования в венах представлена на рис. 47.
8.5.3. Клинические парадигмы артериального тромбоза
Типичными проявлениями артериального тромбоза являются тромботическая тромбо-ци-топеническая пурпура (ТТП) и гемолитико-уре-мический синдром (ГУС).
Клиническая картина ТТП складывается из тромбоцитопении, гемолитической анемии и флуктуирующих признаков ишемии, сочетающихся с расстройствами нервной системы. Большинство этих синдромов характерно и для ГУС, отличающегося от ТТП наличием признаков острой почечной недостаточности и отсутствием неврологической симптоматики. Тромбо-тические массы, состоящие из тромбоцитов и небольших количеств фибрина, разбросаны при ТТП по всей артериокапиллярной системе, вызывая при этом характерную интермиттирующую симптоматику и признаки ишемии в самых различных органах.
При ГУС внутрисосудистая агрегация тромбоцитов с усиленным фибриногенезом почти исключительно ограничена бассейном почечных сосудов. В обеих ситуациях (и при ТТП, и при ГУС) степень внутрисосудистой агрегации коррелирует с уровнем тромбоцитопении. У больных ТТП количество тромбоцитов ниже, чем у больных ГУС.
Наряду с тромбоцитопенией для большинства больных ТТП и ГУС характерна фрагментация эритроцитов, вызванная затруднением движения их по частично тромбированным артериолам и капиллярам. Часто развиваются симптомы мик-
Глава 8 / ПАТОФИЗИОЛОГИЯ ПЕРИФЕРИЧЕСКОГО
роангиопатической гемолитической анемии с характерной морфологической картиной шизо-цитоза («обрезанная» форма эритроцитов), выявляющейся в мазках периферической крови.
8.5.4. Клинические парадигмы венозного тромбоза
Клиническим вариантом венозного тромбоза являются синдром диссеминированного внутри-сосудистого свертывания крови (ДВС), а также врожденный дефицит антитромбина III, протеинов С и S.
Синдром диссеминированного внутрисосу-дистого свертывания крови (ДВС-синдром). В основе ДВС-синдрома лежит избыточная активация либо «внешнего», либо «внутреннего» пути свертывания крови. Наиболее частой причиной синдрома является септицемия, сопровождающаяся деструкцией клеток крови и прежде всего нейтрофилов, а также обширные некрозы тканей после травм и хирургических вмешательств. В обеих ситуациях имеет место преимущественная активация «внешнего» каскада свертывания крови, заканчивающаяся рекуррентным венозным тромбоэмболизмом.
Описаны четыре стадии развития ДВС-синдрома: 1) гиперкоагуляция (вследствие активации контактных факторов гемостаза или появления в кровотоке активированного тканевого тромбоп-ластина); 2) нарастающая коагулопатия потребления (в связи с усиленным расходом факторов свертывающей системы на генерацию фибрина, а тромбоцитов - на агрегацию); 3) гипокоагуля-ция (в связи с истощением запасов фибриногена и нередко развивающегося гиперфибринолиза); 4) восстановление (на фоне постепенной нормализации процесса гемокоагуляции).
Дефицит антитромбина III. Врожденный дефицит встречается редко, больные являются гетерозиготами по аномальному локусу аутосом-ноструктурного гена. Дефицит антитромбина III у гомозигот неизвестен (вероятно, из-за несовместимости с жизнью). Заболевание характеризуется повторными эпизодами венозных (реже артериальных) тромбов с массовыми окклюзия-ми.
Дефицит протеинов Сив. Описаны как ге-теро-, так и гомозиготные формы заболевания. Встречаются у новорожденных детей с purpura
(ОРГАННОГО) КРОВООБРАЩЕНИЯ
Наиболее частые причины нарушений мозгового кровообращения
| НАРУШЕНИЯ МОЗГОВОГО РОВООБРАЩЕНИЯ |
Схема 15
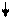 Изменения в кровеносной системе головного мозга Изменения в кровеносной системе головного мозга
|
| Изменения реологических свойств крови в микро-циркуляторном русле мозга |
Изменения центрального кровообращения (обьема циркулирующей крови, сердечного выброса, общего периферического сопротивления)
| Изменения просвета мозговых сосудов (спазм, склероз.тромбоз и т. д.) |
 |
Изменения общего
 артериального давления:
артериального давления:

 гипер- и гипотензия
гипер- и гипотензия
pulmonalis - обширной, нередко фатальной формой ДВС-синдрома, сочетающегося с тромбозом артериол и геморрагическим инфарктом кожи.
8.6. ПАТОФИЗИОЛОГИЯ МОЗГОВОГО КРОВООБРАЩЕНИЯ
Нейроны являются наиболее чувствительными структурными элементами организма к расстройству кровоснабжения и к гипоксии. Поэтому в процессе эволюции животного мира развилась совершенная система регулирования мозгового кровообращения. Благодаря ее функционированию в физиологических условиях величина кровотока всегда соответствует интенсивности обмена веществ в каждом участке мозговой ткани. При патологии та же система регулирования обеспечивает быструю компенсацию различных циркуляторных нарушений в головном мозге. У каждого больного важно идентифицировать чисто патологические и компенсаторные изменения мозгового кровообращения, так как без этого невозможно правильно подбирать лечебные воздействия, которые устраняли бы нарушения и способствовали их компенсации в организме.
Несмотря на совершенную систему регулирования мозгового кровообращения, патогенные влияния на организм (в том числе стрессорные факторы) столь часты и интенсивны в современных условиях, что согласно статистике различные расстройства мозгового кровообращения оказались наиболее частыми причинами (или способствующими факторами) нарушения функций головного мозга. При этом выраженные морфологические изменения в сосудах головного мозга (например, склеротические изменения
сосудистых стенок, тромбоз сосудов и т.д.) обнаруживаются не во всех случаях. Это означает, что нарушения мозгового кровообращения имеют функциональный характер, например возникают вследствие спазма мозговых артерий или же резкого повышения или понижения общего артериального давления, и могут приводить к выраженным нарушениям функции головного мозга и нередко к смерти.
Нарушения мозгового кровообращения могут быть связаны: 1) с патологическими изменениями системного кровообращения (главным образом с артериальной гипер- или гипотензией); 2) с патологическими изменениями в сосудистой системе самого мозга. Это могут быть первичные изменения просвета мозговых сосудов, главным образом артерий (вызываемые, например, их спазмом или тромбозом), либо изменения реологических свойств крови (связанные, например, с усиленной внутрисосудистой агрегацией эритроцитов, вызывающей развитие стаза в капиллярах) (схема 15).
8.6.1. Нарушения и компенсация мозгового кровообращения при артериальной гипер- и гипотензии
Изменения уровня общего артериального давления при гипер- и гипотензии, естественно, не могут не отражаться на кровотоке в мозговых сосудах (как и других органов), так как арте-риовенозная разность давлений является одним из основных факторов, определяющих интенсивность периферического кровотока. При этом роль изменений артериального давления более значительна, чем венозного. В патологических условиях изменения общего артериального давления могут быть весьма значительны - в преде-
Часть II. ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ
лах от 0 до 300 мм рт. ст. (общее венозное давление же может изменяться только от 0 до 20 мм рт. ст.) и наблюдаются значительно чаще. Артериальная гипер- и гипотензия вызывает соответствующие изменения уровня кровяного давления и величины кровотока во всей сосудистой системе головного мозга, приводя к тяжелым нарушениям мозгового кровообращения. Так, наступающее вследствие артериальной гипертен-зии повышение кровяного давления в сосудах мозга может вызвать: а) кровоизлияния в ткань мозга (особенно если стенки его сосудов патологически изменены); б) отек мозга (особенно при соответствующих изменениях гематоэнцефали-ческого барьера и ткани мозга) и в) спазмы мозговых артерий (если имеют место соответствующие изменения их стенок). При артериальной гипотензии понижение артериовенозной разницы давлений может приводить к ослаблению мозгового кровотока и к дефициту кровоснабжения ткани мозга, нарушая ее обмен веществ вплоть до гибели структурных элементов.
В процессе эволюции сформировался механизм регулирования мозгового кровообращения, который в значительной степени компенсирует все эти нарушения, обеспечивая постоянство кровяного давления и кровотока в сосудах головного мозга независимо от изменений общего артериального давления (рис. 48). Пределы такого регулирования могут быть неодинаковыми у разных людей и даже у одного и того же человека и зависят от его состояния (физиологического или патологического). Благодаря регулированию у многих гипер- и гипотоников мозговой кровоток остается в пределах нормы (50 мл крови на 100 г ткани мозга в 1 мин) и отсутствуют какие-либо симптомы изменений кровяного давления и кровотока в головном мозге.
Исходя из общих законов гемодинамики, физиологический механизм регулирования мозгового кровообращения обусловлен изменениями сопротивления в сосудистой системе головного мозга (цереброваскулярного сопротивления), т. е. активной констрикцией мозговых сосудов при повышении общего артериального давления и их дилятацией при понижении. Исследования последних десятилетий выяснили некоторые звенья физиологического механизма этого регулирования.
Так, известными стали сосудистые эффекто-
ры, или «сосудистые механизмы» регулирования мозгового кровообращения. Оказалось, что активные изменения цереброваскулярного сопротивления осуществляются прежде всего магистральными артериями мозга - внутренними сон-

|
Предел регулирования



 /
/
------------- 1----------------- 1---------------- 1----------- *■
50 100 150
Уровень среднего артериального давления (мм рт. ст.)
Рис. 48. Регулирование мозгового кровообращения, обеспечивающее компенсацию кровяного давления и кровотока в сосудистой системе головного мозга при
 изменениях уровня общего артериального давления (гипо- и гипертензии)
изменениях уровня общего артериального давления (гипо- и гипертензии)
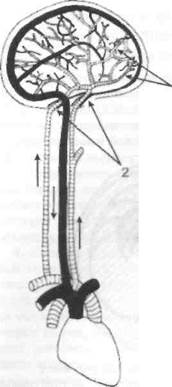
1 Рис. 49. Сосудистые эффекторы регулирования мозгового кровообращения -системы пиальных и магистральных артерий: - пиальные артерии, посредством которых регулируется величина микроциркуляции (соответствующая интенсивности обмена веществ) в небольших участках мозговой ткани; - магистральные артерии мозга (внутренние сонные и позвоночные), посредством которых поддерживается постоянство кровяного давления, кровотока и объема крови в кровеносной системе головного мозга при нормальных и патологических условиях
ными и позвоночными. Однако когда реакции этих сосудов недостаточны, чтобы поддержать постоянство мозгового кровотока (а вследствие этого микроциркуляция становится_неадекш|т-ной метаболи ческим потребностям мозговой тка-_ ни), в регулирование включаются реакции более мелких артерий мозга, в частности пиаль-ных, расположенных на поверхности больших полушарий (рис. 49).
Выяснение конкретных эффекторов этого регулирования позволило проанализировать физиологический механизм вазомоторных реакций мозговых сосудов. Если первоначально предполагали, что вазоконстрикция в мозге при гипер-тензии и вазодилятация при гипотензии связаны только с миогенными реакциями самих мозговых артерий, то сейчас накапливается все больше экспериментальных доказательств, что эти сосудистые реакции осуществляются нейроген-но, т. е. обусловлены рефлекторным вазомоторным механизмом, который приводится в действие изменениями кровяного давления в соответствующих отделах артериальной системы головного мозга.
8.6.2. Нарушения и компенсация мозгового кровообращения при венозном застое крови
Затруднение оттока крови из сосудистой системы головного мозга, вызывающее в нем венозный застой крови (см. разд. 8.3), весьма опасно для мозга, находящегося в герметически замкнутой черепной коробке. В ней помещаются две
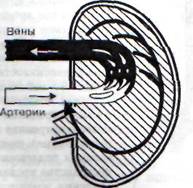
Рис. 50. Вено-вазомоторный рефлекс с механорецепторов венозной системы, регулирующих постоянство объема крови внутри черепа на магистральные артерии мозга
несжимаемые жидкости - кровь и цереброспинальная жидкость, а также ткань мозга (состоящая на 80% из воды, потому малосжимаемая). Увеличение объема крови в сосудах мозга (которое неизбежно сопутствует венозному застою крови) вызывает повышение внутричерепного давления и сдавление мозга, нарушая, в свою очередь, его кровоснабжение и функцию.
Вполне естественно, что в процессе эволюции животного мира развился весьма совершенный регулирующий механизм, устраняющий такие нарушения. Экспериментами было доказано, что сосудистыми эффекторами этого механизма являются магистральные артерии мозга, которые активно суживаются, как только затрудняется отток венозной крови из черепа. Данный регулирующий механизм работает посредством рефлекса с механорецепторов венозной системы головного мозга (при увеличении в ней объема крови и кровяного давления) на его магистральные артерии (рис. 50).
При этом наступает их констрикция, ограничивающая приток крови в мозг и венозный застой в его сосудистой системе, который может даже полностью устраняться.
8.6.3. Ишемия головного мозга и ее компенсация
Ишемия в головном мозге, так же как в других органах, возникает вследствие сужения или закупорки просвета приводящих артерий (см. разд. 8.2). В естественных условиях это может зависеть от тромбов или эмболов в сосудистом просвете, стенозирующего атеросклероза сосудистых стенок или патологической вазоконстрик-ции, т.е. спазма соответствующих артерий.
Ангиоспазм в головном мозге имеет типичную локализацию. Он развивается главным образом в магистральных артериях и других крупных артериальных стволах в области основания мозга. Это те артерии, для которых при нормальном функционировании (т.е. во время регулирования мозгового кровотока) более типичны кон-етрикторные реакции. Спазм более мелких ветвлений пиальных артерий развивается реже, поскольку наиболее типичными для них являются дилятаторные реакции при регулировании микроциркуляции в коре мозга.
При сужении или закупорке отдельных артериальных ветвей головного мозга ишемия раз-
Часть II. ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ
ьется в нем не всегда или же наблюдается в ■ ч inn с участках ткани, что объясняется нами в артериальной системе мозга многочис-sjx анастомозов, связывающих между собой: магистральные артерии мозга (две внутрен-гонные и две позвоночные) в области вилли-хруга, так и крупные, а также мелкие аьные артерии, расположенные на поверх-i мозга. Благодаря анастомозам быстро воз-кает коллатеральный приток крови в бассейн озолоченной артерии. Этому способствует по-^£ нно наблюдаемая при таких условиях диля-жя ветвлений пиальных артерий, расположен-i к периферии от места сужения (или заку-:) кровеносных сосудов. Такие сосудистые и служат не чем иным, как проявлением ования микроциркуляции в мозговой ев, обеспечивающей ее адекватное кровоснабжение.
[ри данных условиях вазодилятация бывает scza наиболее выраженной в области мелких ых артерий, а также их активных сег-гов - сфинктеров ответвлений и прекорти-яых артерий (рис. 51). Физиологический ме-зм, обусловливающий эту компенсаторную кдалятацию, еще недостаточно изучен. Рань-редполагали, что указанные сосудистые ре-веж, регулирующие кровоснабжение ткани, вникают вследствие диффузии дилятаторных эолитов (ионов водорода и калия, аденози-стороны тканевых элементов мозга, испы-лощих дефицит кровоснабжения, к стенкам икающих их кровью сосудов. Однако теперь тся много экспериментальных доказательств ее. что компенсаторная вазодилятация в боль-лени зависит от нейрогенного механиз-
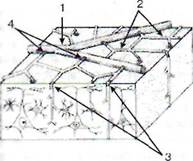
в:. 51. Система пиальных артерий на поверхности /Зного мозга с активными сосудистыми сегментами: I - крупные пиальные артерии; 2 - мелкие яальные артерии: 3 - прекортикальные артерии; 4 - сфинктеры ответвлений
Гшаа8 / ПАТОФИЗИОЛОГИЯ ПЕРИФЕРИЧЕСКОГО
Изменения микроциркуляции в головном мозге при ишемии в принципе те же, что и в других органах тела (см. разд. 8.2.2).
8.6.4. Нарушения микроциркуляции, вызванные изменениями реологических свойств крови
Изменение текучести (вязкостных свойств) крови является одной из основных причин нарушений микроциркуляции, а следовательно, и адекватного кровоснабжения мозговой ткани. Такие изменения крови влияют прежде всего на ее течение по микроциркуляторному руслу, особенно по капиллярам, способствуя замедлению в них кровотока вплоть до полной остановки. Факторами, вызывающими нарушения реологических (вязкостных) свойств и, следовательно, текучести крови в микрососудах, являются:
1. Усиленная внутрисосудистая агрегация
эритроцитов, которая даже при сохраненном
градиенте давлений на протяжении микрососу
дов вызывает в них замедление кровотока раз
ной степени вплоть до его полной остановки.
2. Нарушение деформируемости эритроцитов, зависящее главным образом от изменений механических свойств (податливости) их наружных мембран, имеет большое значение для текучести крови по капиллярам головного мозга. Диаметр просвета капилляров здесь меньше, чем поперечник эритроцитов, и потому при нормальном течении крови по капиллярам эритроциты перемещаются в них только в сильно деформированном (вытянутом в длину) состоянии. Деформируемость эритроцитов в крови может нарушаться под влиянием различных патогенных воздействий, создавая значительное препятствие для нормального течения крови по капиллярам мозга и нарушая кровоток.
3. Концентрация эритроцитов в крови (местный гематокрит), которая также может отражаться на текучести крови по микрососудам. Однако это влияние здесь, по-видимому, меньше выражено, чем при исследовании в вискозиметрах крови, выпущенной из сосудов. В условиях организма концентрация эритроцитов в крови может влиять на ее текучесть по микрососудам косвенно, поскольку увеличение количества эритроцитов способствует образованию их агрегатов.
(ОРГАННОГО) КРОВООБРАЩЕНИЯ
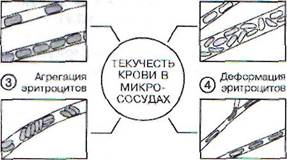
|
| Концентрация ^г\ Структура эритроцитов *ч2/ кровотока |
Рис. 52. Факторы, определяющие микрореологические свойства крови в капиллярах и прилегающих к ним мелких артериях и венах
4. Структура потока крови (ориентация и траектория движения эритроцитов в сосудистом просвете, профиль скоростей в нем и т. д.), являющаяся важным фактором, который определяет нормальную текучесть крови по микрососудам (особенно по мелким артериальным ветвлениям с диаметром меньше 100 мкм). При первичном замедлении кровотока (например, при ишемии) структура потока крови меняется таким образом, что текучесть ее снижается, способствуя еще большему замедлению кровотока во всем микроциркуляторном русле и вызывая нарушение кровоснабжения тканей.
Описанные изменения реологических свойств крови (рис. 52) могут происходить во всей кровеносной системе, нарушая микроциркуляцию в организме в целом. Однако они могут возникать также местно, например только в кровеносных сосудах головного мозга (во всем мозге или в его отдельных частях), нарушая в них микроциркуляцию и функцию окружающих нейронных элементов.
8.6.5. Артериальная гиперемия в головном мозге
Изменения кровотока типа артериальной гиперемии (см. разд. 8.1) возникают в головном мозге при резком расширении ветвлений пиаль-ных артерий. Эта вазодилятация возникает обычно при недостаточности кровоснабжения мозговой ткани, например при значительном усилении ее активности и повышении интенсивности обмена веществ (особенно в случаях появления судорожной активности, в частности в эпилеп-
тических очагах), являясь аналогом функциональной гиперемии в других органах. Расширение пиальных артерий может иметь место также при резком понижении общего артериального давления, при закупорке крупных ветвей мозговых артерий и становится еще более выраженным в процессе восстановления кровотока в ткани мозга после ее ишемии, когда развивается постишемическая (или реактивная) гиперемия.
Артериальная гиперемия в головном мозге, сопровождающаяся увеличением объема крови в его сосудах (особенно если гиперемия развилась в значительной части мозга), может приводить к повышению внутричерепного давления. В связи с этим наступает компенсаторное сужение системы магистральных артерий - проявление регулирования постоянства объема крови внутри черепа.
При артериальной гиперемии интенсивность кровотока в сосудистой системе мозга может намного превышать метаболические потребности его тканевых элементов, что бывает особенно выражено после тяжелой ишемии или травмы мозга, когда его нейронные элементы повреждены и обмен веществ в них понижается. В этих случаях кислород, приносимый кровью, не усваивается мозговой тканью, и потому в венах мозга течет артериализированная (красная) кровь. Такое явление давно заметили нейрохирурги, назвав его избыточной перфузией мозга с типичным признаком - красной венозной кровью. Это показатель тяжелого и даже необратимого состояния головного мозга, которое часто заканчивается смертью пациента.
8.6.6. Отек головного мозга
Развитие отека головного мозга тесно связано с нарушениями его кровообращения (схема 16). С одной стороны, циркуляторные изменения в мозге могут быть непосредственными причинами отека. Это имеет место при резком повышении кровяного давления в мозговых сосудах вследствие значительного подъема общего артериального давления (отек называют гипер-тензивным). Ишемия головного мозга также может быть причиной отека, называемого ише-мическим. Такой отек развивается вследствие того, что при ишемии повреждаются структурные элементы мозговой ткани, в которых начинаются процессы усиленного катаболизма (в част-
Часть II. ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ
Схема 16 Патогенная и компенсаторная роль циркуляторных факторов в развитии отека головного мозга
1. Как причина отека
2. Как способствующий фактор 3. Как ограничивающий фактор
 Артериальная гипо-тензия Артериальная гипо-тензия
|
 Артериальная гипертензия
Артериальная гипертензия
Вшяительное
повышение
ооеяного
язвления в
микрососудах
мозга
 | |||
 | |||
Усиление процессов катаболизма в мозговой ткани
Повышение
 осмолярно-
осмолярно-
 сти ткани
сти ткани
мозга

Нарушение функции ге-матоэнце-фалическо-го барьера
 Повреждение ткани мозга
Повреждение ткани мозга
 Артериальная гипер-тензия Артериальная гипер-тензия
|

Артериальная гиперемия и застой крови в мозге
Повышение кровяного давления в микрососудах мозга
 |
Превалирование фильтрации над резорбцией воды и электролитов в микрососудах мозга усиление отека
Ослабление
кровотока
в мозге
 Понижение кровяного давления в микрососудах мозга
Понижение кровяного давления в микрососудах мозга
 Превалирование резобции над фильтрацией воды в микрососудах мозга – ограничение отека Превалирование резобции над фильтрацией воды в микрососудах мозга – ограничение отека
|
Усиленная фильтрация воды и электролитов «е крови в ткань мозга и их ретенция в ней
гги, распад крупных молекул белка) и появ-оолыпое количество осмотически актив-фрагментов макромолекул ткани. Повыше-эсмотического давления в мозговой ткани, свою очередь, обусловливает усиленный пере- i воды с растворенными в ней электролитами зеносных сосудов в межклеточные про-■ ранства, а из них внутрь тканевых элементов ига, которые при этом резко набухают. Г другой стороны, изменения микроцир-етдяции в мозге могут сильно влиять на разви-е отека любой этиологии. Решающую роль грают изменения уровня кровяного давления в жвкрососудах мозга, во многом определяющие степень фильтрации воды с электролитами из крови в тканевые пространства мозга. Поэтому зозникновение артериальной гиперемии или ве-возвгого застоя крови в мозге всегда способствует развитию отека, например после черепно-мозговой травмы. Большое значение также имеет хггояние гематоэнцефалического барьера, так ок от него зависит переход в тканевые пространства из крови не только осмотически активных частиц, но и других компонентов плазмы крова, как, например, жирных кислот и т. д., которые, в свою очередь, повреждают ткань мозга и евособствуют накоплению в ней избыточного величества воды.
Используемые для лечения отека осмотически активные вещества, повышающие осмолярность крови, часто оказываются малоэффективными с точки зрения предотвращения отека головного мозга. Циркулируя в крови, они способствуют резорбции воды главным образом из неповрежденной ткани мозга. Что же касается тех частей мозга, в которых отек уже развился, дегидратация их нередко не происходит из-за того, что, во-первых, в поврежденной ткани имеются условия, способствующие задержке жидкости (высокая осмолярность, набухание клеточных элементов), и, во-вторых, вследствие нарушения гематоэнцефалического барьера осмотически активное вещество, введенное с терапевтической целью в кровь, само переходит в ткань мозга и еще более способствует задержке там воды, т. е. вызывает усиление отека мозга, вместо того чтобы его ослабить.
|
|