
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Молекулярно - кинетическая теория газов.
|
|
Основным уравнением молекулярно - кинетической теории является:

|
p - давление газа;
V - объём газа;
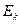 - средняя суммарная кинетическая энергия n молекул газа, находящихся в объёме V при давлении P, имеющим массу
- средняя суммарная кинетическая энергия n молекул газа, находящихся в объёме V при давлении P, имеющим массу 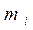 и скорости
и скорости 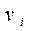 .
.
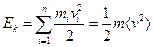 для одноатомного газа.
для одноатомного газа.
Идеальный газ - это газ, в котором отсутствуют силы межмолекулярного взаимодействия, т. е. молекулы считаются упругими твердыми шариками соударения между которыми абсолютно упругие, силы притяжения межу ними отсутствуют.
Пример: разряженные газы
Для идеального газа выполняются законы:
Закон Бойля - Мариотта
m - const, T - const.
рV = const - был выведен закон.
Закон Гей - Люсака
р - const, m - const.
V=aV0T
a - коэффициент объемного расширения газа
a= 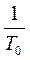
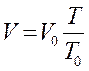
Закон Шарля
m - const, V - const.
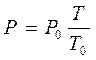
Закон Авогадро
При одинаковых давлениях и одинаковых температурах в равных объёмах различных идеальных газов содержится одинаковое количество молекул и наоборот.
Уравнение состояния для идеального газа:
Уравнение Клайперона - Менделеева.
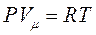
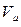 - молярный объём, объём 1 моля газа;
- молярный объём, объём 1 моля газа;
P - давление газа;
T - абсолютная температура;
R - универсальная газовая постоянная, численно равная работе, совершаемой 1 молем идеального газа при изобарном нагревании на 1 градус.
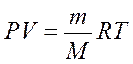 - уравнение Клайперона - Клаузиуса.
- уравнение Клайперона - Клаузиуса.
m - масса газа;
M - молярная асса газа.
|
|