
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач
|
|
Тема 2 ТЕОРИЯ БОРА ДЛЯ ВОДОРОДОПОДОБНЫХ АТОМНЫХ СИСТЕМ
1 Спектральные серии в спектрах водородоподобных атомов, комбинационный принцип Ритца
2 Постулаты Бора, теория Бора для водородоподобных систем
3 Правила квантования эллиптических орбит Бора-Зоммерфельда
4 Преимущества и недостатки теории Бора
Основные понятия по теме
Водородоподобная атомная система состоит из положительно заряженного ядра с зарядом 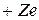 , где
, где 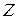 – порядковый номер химического элемента в Периодической системе, и одного электрона, движущегося относительно ядра в соответствии с теорией Бора по замкнутой траектории (орбите). Реальными водородоподобными атомными системами являются атом водорода (
– порядковый номер химического элемента в Периодической системе, и одного электрона, движущегося относительно ядра в соответствии с теорией Бора по замкнутой траектории (орбите). Реальными водородоподобными атомными системами являются атом водорода (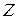 =1), однократно ионизированный атом гелия (
=1), однократно ионизированный атом гелия (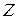 =2), двукратно ионизированный атом лития (
=2), двукратно ионизированный атом лития (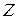 =3) и т. д.
=3) и т. д.
Результаты экспериментальных исследований спектров испускания водородоподобных систем были обобщены посредством формулы, по которой можно определить длину волны 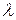 (или волновое число
(или волновое число  , или частоту
, или частоту 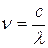 ) любой спектральной линии анализируемых атомных систем:
) любой спектральной линии анализируемых атомных систем:
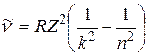 . (2.1)
. (2.1)
Выражение (2.1) называют обобщенной формулой Бальмера.
Здесь 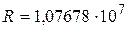 м-1 – постоянная Ридберга, k = 1, 2, 3, …; n = (k + 1), (k + 2), ….
м-1 – постоянная Ридберга, k = 1, 2, 3, …; n = (k + 1), (k + 2), ….
При k = 1, n = 2, 3, 4, … по формуле (1.1) можно рассчитать волновые числа спектральной серии Лаймана;
при k = 2, n = 3, 4, 5, … – волновые числа серии Бальмера;
при k = 3, n = 4, 5, 6, … – серии Пашена
при k = 4, n = 5, 6, 7, … – серии Брэкета;
при k = 5, n = 6, 7, 8, … – серии Пфунда и т.д.
Спектральная линия k -й серии, волновое число которой определяется в соответствии с формулой (1.1) при 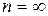 , называется границей k -й серии; а линия с волновым числом
, называется границей k -й серии; а линия с волновым числом 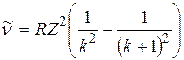 называется головной линией k -й серии.
называется головной линией k -й серии.
Теоретическое обоснование сериальных закономерностей, наблюдаемых в спектрах водородоподобных систем, дано в теории Бора, которая базируется на законах классической механики и квантовых постулатах Бора, согласно которым:
1. Атомы и атомные системы могут длительное время, не излучая и не поглощая энергии, находиться в стационарных состояниях, которым соответствуют значения энергии E1, E2, …, En, …, образующие дискретный ряд.
2. Переходя из стационарного состояния с энергией En в состояние с энергией Ek, атом излучает или поглощает квант электромагнитного излучения, частота которого определяется правилом частот Бора
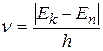 , (2.2)
, (2.2)
где 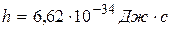 – постоянная Планка.
– постоянная Планка.
Бор в теории для водородоподобных систем рассматривал только круговые орбиты электрона, для которых им сформулировано условие квантования
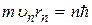 , (n = 1, 2, 3, …), (2.3)
, (n = 1, 2, 3, …), (2.3)
где 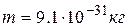 – масса электрона,
– масса электрона, 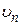 – его скорость,
– его скорость, 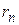 – радиус
– радиус 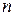 -й орбиты.
-й орбиты.
Смысл условия квантования круговых орбит состоит в том, что в атоме реализуются только такие круговые орбиты, при движении по которым электрон имеет момент количества движения, кратный приведенной постоянной Планка 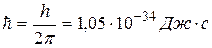 :
:
Второй закон Ньютона для электрона, движущегося по n –й круговой орбите, имеет вид:
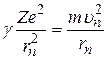 . (2.4)
. (2.4)
где 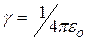 ,
, 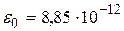 Ф/м – диэлектрическая постоянная.
Ф/м – диэлектрическая постоянная.
Решив систему уравнений (2.3) и (2.4) относительно радиуса 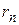 и скорости электрона
и скорости электрона 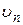 и выразив полную энергию электрона n –й круговой орбите
и выразив полную энергию электрона n –й круговой орбите
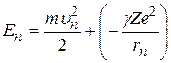 , (2.5)
, (2.5)
Бор получил формулу
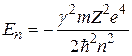 . (2.6)
. (2.6)
Воспользовавшись правилом частот (2.2) и связью 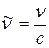 , он выразил волновое число спектральной линии, обусловленной квантовым переходом атомной системы из n -го стационарного состояния в k- е:
, он выразил волновое число спектральной линии, обусловленной квантовым переходом атомной системы из n -го стационарного состояния в k- е:
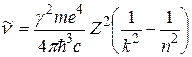 . (2.7)
. (2.7)
Как видим, эмпирическое выражение (2.1) для волнового числа спектральной линии и теоретическое (2.7) совпадают, если принять, что
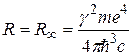 . (2.8)
. (2.8)
Расчетное значение постоянной Ридберга (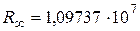 м-1) хорошо согласуется с экспериментальным (
м-1) хорошо согласуется с экспериментальным (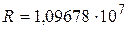 м-1), что является основанием для вывода о правильности предложенной Бором модели. Некоторое отличие этих значений удалось объяснить, введя поправку в полученное решение, учитывающую в атоме наряду с движением электрона и движение ядра, масса которого
м-1), что является основанием для вывода о правильности предложенной Бором модели. Некоторое отличие этих значений удалось объяснить, введя поправку в полученное решение, учитывающую в атоме наряду с движением электрона и движение ядра, масса которого 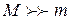 . С формальной точки зрения это означает, что во всех соотношениях теории Бора необходимо заменить массу электрона
. С формальной точки зрения это означает, что во всех соотношениях теории Бора необходимо заменить массу электрона 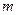 приведенной массой
приведенной массой 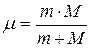 системы, состоящей из ядра и электрона. При этом эмпирическое значение постоянной Ридберга
системы, состоящей из ядра и электрона. При этом эмпирическое значение постоянной Ридберга 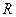 и теоретическое значение ее
и теоретическое значение ее 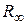 связаны следующим образом:
связаны следующим образом:
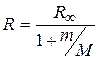 . (2.9)
. (2.9)
Зависимость постоянной Ридберга от массы ядра обусловливает смещение соответствующих спектральных линий, характерных для различных изотопов данного химического элемента, и называется изотопическим сдвигом.
На рисунке 2.1 приведена схема энергетических уровней и переходов между ними для водородоподобного атома, построенная в результате анализа формул (2.2) и (2.6).
Стационарное состояние с наименьшей энергией (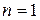 ) называется основным, или нормальным, все остальные состояния (
) называется основным, или нормальным, все остальные состояния (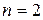 , 3, …) – возбужденные. При
, 3, …) – возбужденные. При 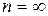 , согласно (2.6), En = 0. При E < 0 электрон связан с ядром и спектр значений его энергий дискретен (энергия квантована); при E > 0 электрон свободен и спектр значений его энергии непрерывен. Переход электрона в области дискретного спектра из одного энергетического состояния в другое, с большей энергией, есть возбуждение атома. При переходе электрона с одного из уровней дискретного спектра в область непрерывного спектра энергий атом превращается в несвязанную систему «положительный ион + электрон», то есть происходит его ионизация.
, согласно (2.6), En = 0. При E < 0 электрон связан с ядром и спектр значений его энергий дискретен (энергия квантована); при E > 0 электрон свободен и спектр значений его энергии непрерывен. Переход электрона в области дискретного спектра из одного энергетического состояния в другое, с большей энергией, есть возбуждение атома. При переходе электрона с одного из уровней дискретного спектра в область непрерывного спектра энергий атом превращается в несвязанную систему «положительный ион + электрон», то есть происходит его ионизация.
 |
Минимальная энергия, необходимая для ионизации атома из 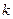 -го состояния, соответствует переходу электрона с
-го состояния, соответствует переходу электрона с 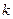 -го уровня на уровень
-го уровня на уровень 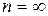 и называется энергией ионизации Ei.
и называется энергией ионизации Ei.
Вопросы для самоконтроля
1 Запишите обобщенную формулу Бальмера.
2 Что называется спектральной серией, головной линией и границей спектральной серии?
3 Сформулируйте постулаты Бора.
4 Изложите сущность теории Бора для водородоподобных систем.
5 Изобразите и поясните схему энергетических уровней атома водорода.
6 В чем состоит явление изотопического сдвига?
Задачи
1 Основываясь на модели атома, предложенной Бором, получите формулы для расчета радиуса 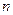 -й орбиты и скорости движения электрона в водородоподобном атоме в этом состоянии. Вычислите радиусы первой и второй боровских орбит для электрона, движущегося в атоме водорода и ионах
-й орбиты и скорости движения электрона в водородоподобном атоме в этом состоянии. Вычислите радиусы первой и второй боровских орбит для электрона, движущегося в атоме водорода и ионах 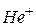 ,
, 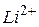 . Сравните результаты.
. Сравните результаты.
2 Определите частоту вращения электрона по второй боровской орбите атома водорода.
3 Вычислите для атомарного водорода длины волн головных линий: а) серии Лаймана; б) серии Бальмера; в) серии Пашена.
4 Вычислите для однократно ионизированного атома гелия коротковолновые границы (нм): а) серии Бальмера; б) серии Пашена; в) серии Брэкета.
5 Определите: а) потенциал ионизации атома водорода; б) первый потенциал возбуждения атома водорода; в) энергию ионизации атома водорода из первого возбужденного состояния.
6 Какой серии принадлежит спектральная линия атомарного водорода, волновое число которой равно разности волновых чисел следующих двух линий: 486, 1 нм; 410, 2 нм? Какова длина волны этой линии?
7 Предполагая, что в опыте Франка и Герца вакуумная трубка наполнена не парами ртути, а разреженным атомарным водородом, определите, через какие интервалы ускоряющего потенциала возникнут максимумы на графике зависимости анодного тока от ускоряющего потенциала.
8 Вычислите минимальную разрешающую способность 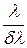 спектрального прибора, при которой в спектре атомарного водорода можно разрешить первые 20 линий серии Бальмера.
спектрального прибора, при которой в спектре атомарного водорода можно разрешить первые 20 линий серии Бальмера.
9 Вычислите отношение массы протона к массе электрона, если известно, что отношение постоянных Ридберга для тяжелого и легкого водорода 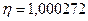 , а отношение масс ядер
, а отношение масс ядер 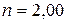 .
.
10 Определите кинетическую, потенциальную и полную энергию электрона, движущегося по первой боровской орбите: а) в атоме водорода; б) в ионе 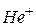 ; в) в ионе
; в) в ионе 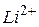 . Сравните результаты.
. Сравните результаты.
11 Определите в электрон-вольтах (эВ) наибольшую и наименьшую энергии фотонов, которые излучаются при совершении атомами водорода переходов, соответствующих серии Лаймана.
12 Атомарный водород, возбужденный электромагнитным излучением определенной длины волны, при переходе в основное состояние испускает только три спектральные линии. Определите длины волн этих линий и укажите, каким сериям они принадлежат.
13 Атом водорода в основном состоянии поглотил квант света с длиной волны 121, 5 нм. Определите радиус электронной орбиты возбужденного атома водорода.
14 У какого водородоподобного иона разность длин волн головных линий серии Бальмера и Лаймана равна 59, 3 нм?
15 Атом водорода, двигавшийся со скоростью 3, 26 Мм/с, испустил фотон, соответствующий переходу из первого возбужденного состояния в основное. Найдите угол между направлением вылета фотона и первоначальным направлением движения атома, если кинетическая энергия атома осталась прежней.
16 Определите изменение орбитального механического момента электрона, если он переходит из возбужденного состояния в основное с испусканием фотона с длиной волны λ = 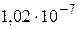 м.
м.
17 В излучении звезды обнаружен водородоподобный спектр, длины волн которого в 9 раз меньше, чем у атомарного водорода. Определите элемент, которому соответствует данный спектр.
18 Вычислите энергию фотона, испускаемого при переходе электрона в атоме водорода с третьего энергетического уровня на первый.
19 Определите частоту света, излучаемого возбужденным атомом водорода при переходе электрона на второй энергетический уровень, если радиус орбиты электрона изменился в 9 раз.
20 Определите, на сколько электрон-вольт изменяется кинетическая энергия электрона в атоме водорода при излучении атомом фотона с длиной волны 486 нм.
21 Позитроний – атомоподобная система, состоящая из позитрона и электрона, вращающихся относительно их общего центра масс. Применяя теорию Бора, определите минимальные размеры такой системы.
Примеры решения задач
1 Пользуясь теорией Бора, выведите формулы для потенциальной, кинетической и полной энергии электрона, движущегося по  -й орбите в водородоподобном атоме.
-й орбите в водородоподобном атоме.
 Дано:
Z,
n
Найти:
Un -?
Tn -?
En -? Дано:
Z,
n
Найти:
Un -?
Tn -?
En -?
| Решение
Потенциальная энергия электрона в водородоподобном атоме, порядковый номер которого в Периодической системе элементов Д. И. Менделеева равен Z, определяется электростатическим взаимодействием электрона и ядра, которые можно считать точечными зарядами:
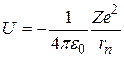 . (2.10) . (2.10)
|
Здесь 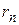 – расстояние между электроном и ядром (радиус
– расстояние между электроном и ядром (радиус 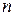 -ой круговой орбиты электрона).
-ой круговой орбиты электрона).
Кинетическая энергия электрона определяется по формуле
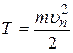 , (2.11)
, (2.11)
где 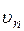 – скорость электрона на
– скорость электрона на 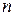 - ой орбите.
- ой орбите.
Для того, чтобы определить радиус 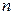 - й орбиты и скорость электрона
- й орбиты и скорость электрона 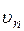 , необходимо решить систему из уравнений (2.3), (2.4):
, необходимо решить систему из уравнений (2.3), (2.4):
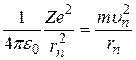 ,
,
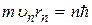 .
.
Получим:
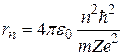 , (2.12)
, (2.12)
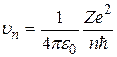 . (2.13)
. (2.13)
Подставляя (2.12) в формулу (2.10), а (2.13) – в формулу (2.11), получим следующие выражения для потенциальной и кинетической энергии электрона, движущегося по 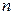 -й орбите:
-й орбите:
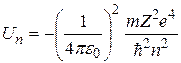 , (2.14)
, (2.14)
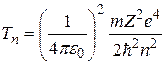 . (2.15)
. (2.15)
Суммируя (2.14) и (2.15), получим выражение для полной энергии электрона, находящегося в 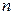 -м стационарном состоянии:
-м стационарном состоянии:
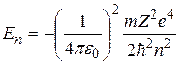 .
.
Ответы: 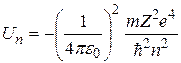 ,
, 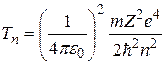 ,
,
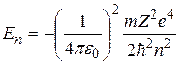 .
.
Дано:
Eф= 16, 5 эВ =26, 4·10-19 Дж
 n= 1
n= 1
| Решение
Для того чтобы определить скорость выбитого из атома электрона, воспользуемся законом сохранения энергии для рассматриваемого явления. Получив энергию Eф, электрон, находящийся в невозбужденном состоянии (n= 1) атома водорода ( ), преодолеет притяжение с ядром, т.е. потратит энергию ), преодолеет притяжение с ядром, т.е. потратит энергию  и, покинув атом, приобретет кинетическую энергию и, покинув атом, приобретет кинетическую энергию 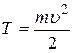 : :
|
Найти:
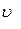 -? -?
|
2 Фотон с энергией 16, 5 эВ выбил электрон из невозбужденного атома водорода. Какую скорость будет иметь электрон вдали от ядра атома?
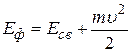 (2.16)
(2.16)
В соответствии с теорией Бора энергия водородоподобной системы в n- м стационарном состоянии определяется по формуле (2.6). При условиях 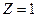 , n= 1 она приобретает вид
, n= 1 она приобретает вид
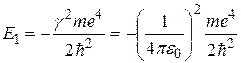 .
.
Затратив энергию связи, электрон станет свободным, т.е. его энергия станет равной нулю. Следовательно,
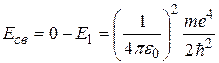 . (2.17)
. (2.17)
Подставляя (2.17) в формулу (2.16) и выражая затем скорость, получим:
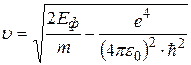 .
.
В результате вычислений определим значение скорости электрона: 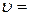 1, 01·106 м/с.
1, 01·106 м/с.
Ответ: 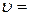 1, 01·106 м/с.
1, 01·106 м/с.
2 Атомарный водород возбуждают на n -й энергетический уровень. Определить длины волн испускаемых линий, если n = 4; каким сериям принадлежат эти линии?
Дано:
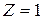 n = 4
n = 4
| Решение Различные атомы водорода, находящиеся в зоне возбуждения и переведенные в возбужденное состояние с n = 4, могут вернуться в основное состояние (n = 1), совершая последовательность различных квантовых переходов. |
Найти: 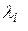 -? -?
|
Воспользуемся схемой энергетических уровней, изображенной на рисунке 2.1, и укажем все возможные последовательности квантовых переходов, совершая которые атомы водорода могут перейти с возбужденного уровня (n = 4) на основной (n = 1):
а) 4→ 3; 3→ 2; 2→ 1;
б) 4→ 2; 2→ 1;
в) 4→ 3; 3→ 1;
г) 4→ 1.
Выпишем неповторяющиеся квантовые переходы:
4 → 3 (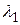 ); 3 → 2 (
); 3 → 2 (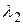 ); 2 → 1(
); 2 → 1(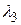 );
);
4 → 2 (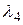 ); 3 → 1 (
); 3 → 1 (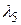 ); 4 → 1. (
); 4 → 1. (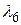 ). (2.18)
). (2.18)
Выразим длины волн спектральных линий, соответствующих всем указанным квантовым переходам, пользуясь обобщенной формулой Бальмера (2.1) и связью между волновым числом и длиной волны излучения  :
:
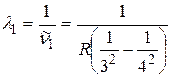 ;
; 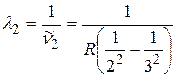 ;
; 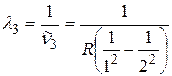 .
.
(2.19)
Длины волн 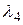 ,
, 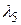 ,
, 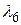 выразим, применяя комбинационный принцип Ритца:
выразим, применяя комбинационный принцип Ритца:
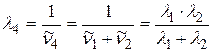 ;
; 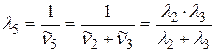 ;
;
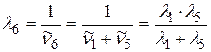 . (2.20)
. (2.20)
Вычислим значений длин волн  ,
,  ,
, 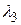
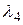 ,
, 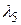 ,
, 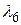 по формулам (2.19), (2.20), учитывая значение постоянной Ридберга (
по формулам (2.19), (2.20), учитывая значение постоянной Ридберга (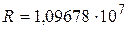 м-1).
м-1).
Получим: 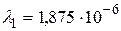 м.
м.
Устанавливая соответствие спектральных линий различным квантовым переходам (2.18) определим, что спектральная линия с длиной волны 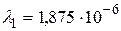 м относится к серии Пашена; линии с длинами волн
м относится к серии Пашена; линии с длинами волн 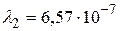 м и
м и 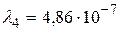 м – серии Бальмера;
м – серии Бальмера; 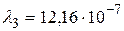 м,
м, 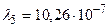 м и
м и 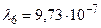 м – серии Лаймана.
м – серии Лаймана.
Ответ: 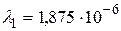 м (серия Пашена);
м (серия Пашена); 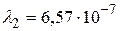 м,
м, 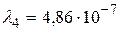 м (серия Бальмера);
м (серия Бальмера); 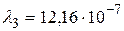 м,
м, 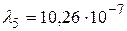 м,
м, 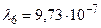 м (серия Лаймана).
м (серия Лаймана).
|
|