
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторная работа № 18
|
|
Карагандинский Государственный Технический Университет
Кафедра: Физики
ЛАБОРАТОРНАЯ РАБОТА № 18
ТЕМА: " Определение отношения 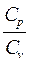 методом Клемана и Дезорма"
методом Клемана и Дезорма"
Выполнил: Студент гр. АиУ-06-2
Голобородько Артём
Проверил(а): преподаватель
Орлова Елена Фёдоровна
Караганда 2006.
Цель работы: Определить экспериментально отношение молярных теплоемкостей газа при постоянном давлении и постоянном объеме и сравнить с теоретическим значением данного отношения, найденным из молекулярно-кинетической теории.
Задачи:
· овладение одной из методик эксперимента
· приобретение опыта решения учебно-исследовательских и реальных практических задач на основе изученного теоретического материала
· приобретение опыта проведения эксперимента
· формирование навыков обработки результатов проведенных исследований
· формирование умений оформления и представления результатов проведенных исследований
· анализ, обсуждение полученных результатов и формулирование выводов.
Методика работы:
Установка состоит: сосуд А, водяной манометр М, ручной насос.
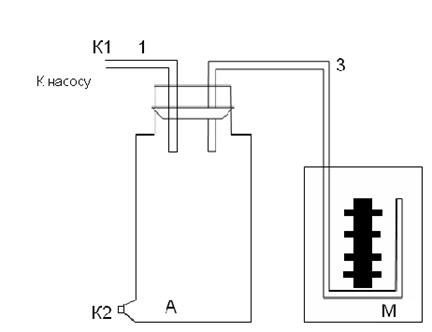
На лабораторной установке баллон А соединен с открытым V -образным водяным манометром М. Рычажной кран через впускной штуцер позволяет сообщаться баллону через резиновую трубку с нагнетающим насосом или с атмосферой. Если с помощью насоса быстро накачать воздух в сосуд и сразу же перекрыть кран, то давление в сосуде повысится. Но при быстром накачивании процесс сжатия воздуха в сосуде может считаться адиабатным, и газ поэтому нагреется. Повышение давления, которое показывает манометр, вызвано и сжатием, и нагреванием. Через 2-3 мин температура воздуха в сосуде становится равной температуре окружающей среды. Обозначив для первого данного состояния газа его удельный объем V1, давление P1, температуру Т1.
Теперь быстро (напомним, что быстрота обеспечивает адиабатность процесса) вытаскивают пробку, при это сосуд соединяется с атмосферой. Давление газа станет равным атмосферному. Новый удельный объем воздуха - V2, давление - P2=P0 (атмосферное) и температура - Т2. Через 2-3 мин воздух в баллоне нагреется до комнатной температуры T3 = Т1, его давление будет P3, а удельный объем V3=V2 (ни масса, ни объем газа не меняются). Переход из первого, состояния во второе (адиабатический процесс) описывается уравнением Пуассона:
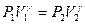
 где
где 
Сравнивая конечное, третье состояние газа с первым, видим, что температура газа в этих состояниях одинакова, следовательно, к этому переходу применим закон Бойля-Мариотта
P1V1=P3V3,
Решая систему двух уравнений можно определить γ. Для этого возведем второе уравнение в степень γ разделим его на первое уравнение:

Так как V2=V3, то 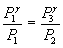 или
или 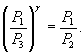
Логарифмируя последнее выражение, получим

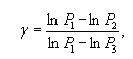
Обозначим разность уровней жидкости в манометре в первом состоянии h1, а в третьем состоянии – h2. Тогда
P1=P0+h1, P3=P0+h2, (P2=P0)
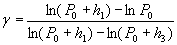 Подставим значения Р1, Р2, Р3 в соотношение:
Подставим значения Р1, Р2, Р3 в соотношение:
В данном случае h1 и h2 намного меньше Р0, поэтому отношение разности логарифмов можно заменить отношением разности чисел, т.е.
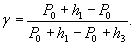
Это дает расчетную формулу для нашего опыта
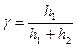



В молекулярно-кинетической теории молярные теплоемкости газа Сp и Сv определяются через число степеней свобода молекулы i и универсальную газовую постоянную R:
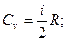
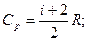
Найдем их отношение:
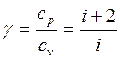 ;
;
В данном случае воздух не очищается от влаги и содержит большое количество паров воды, поэтому число степеней свободы будет соответствовать трехатомным молекулам, т.е. i = 6.
| № | h1 см | h2 см | h1-h2 cм | 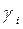
| 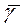
| Δ γ | 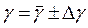
|
| 1, 23 | 1, 22 | 0, 02 | 1, 22±0, 02 | ||||
| 1, 22 | |||||||
| 1, 20 | |||||||
| 1, 20 | |||||||
| 1, 26 | |||||||
| 1, 22 | |||||||
| 1, 20 |
Вывод: На данном этапе опыта, было практически освоено содержание теоретического материала и методы измерений в лабораториях кафедры физики при использовании специальных технических средств.
В результате данного опыта были достигнуты цели лабораторной работы и получены следующие результаты в виде: 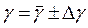 ; Коэффициент отношения теплоемкостей γ был определён, он равен: γ = ( 1, 22±0, 02 );
; Коэффициент отношения теплоемкостей γ был определён, он равен: γ = ( 1, 22±0, 02 );
Анализ:
Данный опыт был проведён с погрешностями, так как измерения производились человеком – присутствовал человеческий фактор, так же имелась инструментальная погрешность в приборах измерения.
Из-за всех этих погрешностей результат опыта не совпадает с теоретическим значением данного отношения, найденным из молекулярно-кинетической теории: γ = 1, 33;
|
|