
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Етапи становлення органічної хімії. Основні положення теорії хімічної будови органічних сполук О.М.Бутлерова та її значення для розвитку органічної хімії.
|
|
ЛЕКЦІЯ №1
Тема: Вступ.Предмет органічна хімія.Теорія будови органічних сполук О.М.Бутлерова.Вуглеводні.
Мета: Вивчити будову органічних сполук. Розглянути властивості та взаємозв'язок будови речовин. Вивчити класифікацію вуглеводнів, електронну будову атому вуглецю. Знати типи гібридизації.
План:
Предмет і значення органічної хімії.
Теорія хімічної будови органічних сполук.
Взаємозв'язок будови і властивості речовин.
Класифікація вуглеводнів.
Електронна будова атому вуглецю.
Гібридизація зв'язків.
Органічна хімія – це хімія атома Карбону та всіх елементів періодичної системи.
Проте не всі сполуки Карбону належать до органічних. Такі найпростіші речовини, як оксид Карбону (II) СО, оксид Карбону (IV) СО2, карбонатна кислота Н2СО3 та її солі, наприклад СаСО3, К2СО3 належать до неорганічних речовин.
До складу органічних речовин крім Карбону можуть входити і інші елементи найчастіше - це Гідроген, галогени, Оксиген, Нітроген, Сульфур та Фосфор. Існують також органічні сполуки, що містять інші елементи, в тому числі метали – металоорганічні сполуки.
З початку об'єктом вивчення органічної хімії були лише речовини, виділені з рослинних або тваринних організмів. У 1828 р. німецький хімік Ф.Велер вперше добув штучно (синтезував) органічну сполуку - сечовину. З цього часу почався бурхливий розвиток органічного синтезу: добуто велику кількість сполук, які не зустрічаються у природі. Предметом вивчення сучасної органічної хімії є всі органічні речовини - як природні, так і синтетичні.
Органічна хімія має велике наукове і практичне значення. Вона сприяє розвитку суміжних галузей науки - біології, медицини, біохімії, агрохімії тощо.
Сучасна хімічна промисловість виробляє важливі для народного господарства продукти - органічні речовини: пластмаси, волокна, каучук, гуму, смоли, бензин, мастила, спирти, розчинники, клеї, фарби тощо. Органічну сировину використовують численні галузі промисловості: нафтохімічна і нафтопереробна, фармацевтична, лісохімічна, харчова.
Велике значення має органічна хімія для сільського господарства. Органічні добрива, засоби боротьби з шкідниками рослин, засоби, що прискорюють або сповільнюють ріст рослин і розвиток плодів, - все це органічні речовини.
До складу органічних речовин крім вуглецю можуть входити і інші елементи найчастіше - це водень, галогени, кисень, азот, сірка та фосфор. Існують також органічні сполуки, що містять інші елементи, в тому числі метали.
Етапи становлення органічної хімії. Основні положення теорії хімічної будови органічних сполук О.М.Бутлерова та її значення для розвитку органічної хімії.
В історії розвитку хімії для органічної хімії відведено три етапи.
Період від першого знайомства людини з органічними речовинами до кінця XVІІІ століття вважається емпіричним. Основний підсумок цього періоду – люди усвідомили значення елементного аналізу і встановлення атомних і молекулярних мас.
Органічна хімія народилась із світу живих організмів. В хімії довгий період часу вважали, що органічні речовини можуть утворюватись тільки в живих організмах під дією “життєвої сили”. Ця теорія довший час існувала і підтримувалась рядом вчених (Берцеліус) і одержала назву “теорії віталізму”. Це вчення сильно гальмувало розвиток органічної хімії, тому що пропагувало ідею про непізнанність світу.
До 60-х років XІX століття продовжувався аналітичний період. Він позначався тим, що з кінця першої чверті XІX століття було зроблено ряд перспективних відкриттів, які нанесли нищівного удару по віталістичній теорії. Першим у цій низці був учень Берцеліуса, німецький хімік Велер. Він здійснив ряд відкритті: 1824 р. – синтез щавлевої кислоти з диціану: (CN)2 ® НООС – СООН.
1828 р. – синтез сечовини з ціановокислого амонію NH4CNO®NH2 – C – NH2
1842 р. – рос. вчений М.М.Зінін – синтез аніліну з нітробензолу.
1854-1862 – франц. вчений Бертло – синтез оцтової кислоти, ацетилену з С і Н.
1861 р. – О.М.Бутлеров – синтез цукристої речовини.
Накопичений експериментальний матеріал вимагав систематизації, узагальнення. В цей період виникають декілька теорій, серед яких потрібно відзначити теорії типів і радикалів, які виникли одна з другої і розвинулись в постійному протиборстві. Ці теорії відіграли позитивну роль, т.я. сприяли ознайомленню з основними хімічними речовинами. Але в них було закладене те, що вивчити внутрішню будову речовин неможливо (Берцеліус, Велер, Лібіх, Кольбе, Жерар і ін.). Ні одна з цих теорій не могла пояснити і узагальнити дослідний матеріал. В 60-ті роки ці теорії зайшли в тупік. Потрібна була нова теорія. Передбачення її вже були:
1) затверджувалось атомно-молекулярне вчення, створювались поняття “атом”, “молекула як хімічна частинка”;
2) 1857 р. Август Кекуле (нім.) і Купер (шотл.) заклали початки теорії валентності. Вони висловили думку, що вуглець 4-х валентний і може утворювати ланцюги. Але під впливом ідей попередників, вони не змогли відкрити нову теорію, не бачили взаємозв’язку між будовою і властивостями.
Накопичений матеріал вимагав систематизації, узагальнення. Таку теорію розробив учень Зініна Олександр Михайлович Бутлеров (1828-1886). Він ще в 1860 році почав розробляти ідеї теорії хімічної будови речовин. На одній з лекцій в Казанському університеті він висловив свої міркування. Свої положення він базував на дослідженнях попередників. На початку XІX століття при дослідженні органічних сполук хіміки звернули увагу на те, що в ряді хімічних перетворень окремі групи атомів у незмінному вигляді переходять з однієї в іншу (1815 р. Ж. Гей-Люссак, 1832 р. Ф.Велер, Ю.Лібіх).
Ф.Велер, Ю.Лібіх і Й.Берцеліус створили першу теорію – теорію радикалів. До радикалів вони віднесли групи атомів, що переходять від сполуки до сполуки. Тому вони висловили думку, що органічні речовини складаються з радикалів.
У 1833-1834 р.р. Ж.Дюма дослідив, що радикали здатні змінюватись. Це було ударом по теорії радикалів.
У 40-х роках XІX століття з’явилась теорія типів (Ш. Жерар). Органічні речовини розглядались як продукти заміщення атомів гідрогену на різні групи.
Але ці теорії були неспроможні пояснити явища, які спостерігались і були характерними для органічних сполук.
О.М.Бутлеров висловив свої міркування у 1861 р. на з’їзді природодослідників у м. Карлруе.
Він піддав критиці попередні теорії і вказав на їх недоліки. Він дав визначення поняттю “хімічна будова”. За висловом О.М.Бутлерова – це послідовність чергування атомів у молекулі.
О.М.Бутлеров писав: “Химическая натура сложной частицы определяется натурой елементарных составных частей, количеством их и химическим строением, а также “химическое значение атомов одного и того же элемента в молекуле обусловлено природой других атомов, соединенных с ним прямо или посредственно”.
Постулювання залежності властивостей речовин від хімічної будови відрізняє теорію О.М.Бутлерова від попередніх теорій.
Велику роль у розвитку органічної хімії відіграла теорія хімічної будови органічних сполук, засновником якої був великий російський хімік - органік О.М. Бутлеров. Розглянемо основні положення цієї теорії.
До робіт О.М.Бутлерова не приділялося достатньо уваги уявленням про розміщення атомів у молекулах, хоча атомно-молекулярне вчення вже утвердилося в хімії. О.М. Бутлеров ввів поняття про хімічну будову - чітко визначений порядок
розміщення атомів у молекулі. В основу теорії будови було покладено валентність елементів - важливу властивість атомів, яка характеризує їхню здатність до утворення хімічних зв'язків. Згідно з теорією Бутлерова в молекулах речовин атоми сполучені один з одним у певній послідовності відповідно до їхньої валентності, тобто молекули мають точну хімічну будову.
О.М. Бутлеров припускав, що вуглець в органічних сполуках чотирьохвалентний, тобто може бути сполучений з чотирма іншими одновалентними атомами. При цьому атоми вуглецю можуть сполучатися один з одним і з атомами різних елементів. Дослідження будови атомів і природи хімічного зв'язку підтвердили ці припущення. Згідно з сучасними електронними уявленнями хімічний ковалентний зв'язок виникає за рахунок неспарених електронів атома. Так, атом вуглецю при утворенні органічної сполуки переходить з основного електронного стану в збуджений.
Чотири орбіталі атома вуглецю, що містять неспарені електрони, дають змогу атому утворити чотири ковалентних зв'язки, тобто бути чотирьохвалентними у сполуках.
3. Хімічну будову молекул органічних речовин записують за допомогою структурних формул, у яких зазначають усі їх хімічні зв'язки між атомами, зв'язок зображають рискою. Згідно з електронною теорією одна риска в структурних формулах означає електронну пару, що сполучає атоми.
Так, структурні формули органічних сполук етану С2Н6, етилену С2Н4 і пропану С3Н8 мають такий вигляд:
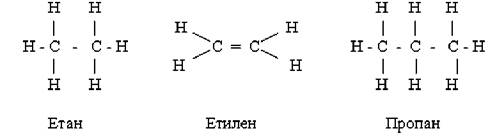
Структурні формули сполук можна зображувати у спрощеній формі, вказуючи тільки зв'язки між атомами вуглецю. Наприклад, формули етану, етилену і пропану можна записати так:
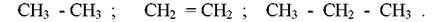
Такий запис широко використовується в органічній хімії.
До створення теорії хімічної будови вважалося, що властивості сполук визначаються тільки їх складом. Це багато в чому правильне положення не могло пояснити явища ізомерії - прояву різних властивостей речовинами, що мають однаковий склад. Такі речовини дістали назву ізомерів. Наприклад, складу С2Н6О відповідають дві органічні сполуки - етиловий спирт (етанол) і диметиловий ефір, які відрізняються за хімічними і фізичними властивостями. Наприклад, етанол реагує з натрієм (при цьому виділяється водень), має температуру кипіння 78°С; диметиловий ефір з натрієм не реагує, кипить при температурі - 24°С.
О.М. Бутлеров показав, що властивості речовин залежать від хімічної будови молекул. Отже, теорія О.М. Бутлерова пояснює явище ізомерії різним розміщенням атомів у молекулах. У прикладі з речовинами складу С2Н6О відмінність у їхніх властивостях зумовлено тим, що етиловий спирт і диметиловий ефір мають різну хімічну будову:
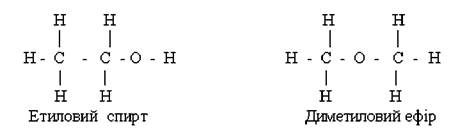
На підставі своєї теорії О.М. Бутлеров висловив припущення про існування деяких речовин. Так, він передбачив, що складу С4Н10 мусять відповідати дві речовини: нормальний бутан і ізобутан. Дійсно, ним був синтезований ізобутан, що підтвердило правильність теоретичних припущень.
Атоми в молекулах впливають один на одного, при цьому найбільш сильний взаємний вплив виявляється у сполучених безпосередньо атомів. Наприклад, до складу молекули етилового спирту входять шість атомів водню, проте лише один з них має досить високу рухливість і може бути заміщений на метал:
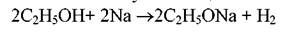
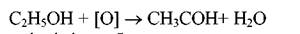 Рухливість одного атома водню пояснюється впливом сполученого з ним атома кисню. Цей атом кисню впливає і на найближчі атоми вуглецю. Наприклад, якщо окислювати дану речовину, то зміни відбуваються лише з атомом вуглецю який сполучений з киснем:
Рухливість одного атома водню пояснюється впливом сполученого з ним атома кисню. Цей атом кисню впливає і на найближчі атоми вуглецю. Наприклад, якщо окислювати дану речовину, то зміни відбуваються лише з атомом вуглецю який сполучений з киснем:
Основні положення теорії хімічної будови полягають ось у чому:
1) атоми в молекулах сполучені у певній послідовності, тобто молекули мають певну хімічну будову;
2) будова молекул зумовлена електронною будовою атомів, що входять до складу молекул;
3) властивості речовини визначаються хімічною будовою молекул та їхнім складом;
4) атоми в молекулах чинять взаємний вплив один на одного, тобто реакційна здатність атомів залежить від того, з якими атомами вони сполучені в молекулі.
|
|